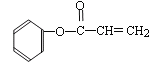
题目内容
【题目】Ⅰ.由三种元素组成的化合物 A,按如下流程进行实验:
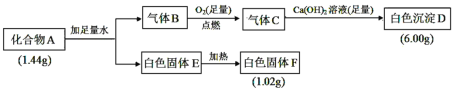
已知:①标准状况下,气体B的密度是氢气的8倍。②固体E既能溶于NaOH溶液又能溶于盐酸。
请回答:
(1)组成 A 的三种元素是__________,A 的化学式是________。
(2)固体 A 与足量稀盐酸反应的化学方程式是__________。
(3)气体 B 与足量 CuO 在加热条件下反应,请写出一个可能的化学方程式________________。
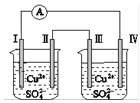
Ⅱ.某兴趣小组为探究 SO2 与 Fe(NO3)3 稀溶液反应的情况,实验装置如图,请回答:
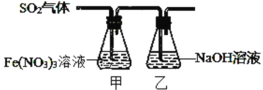
(1)实验过程中,甲中溶液由黄色变为浅绿色但立即又变为黄色。请写出甲中溶液由浅绿色变为黄色的离子方程式_____。
(2)请设计实验方案,检验反应后甲溶液中的金属阳离子______。
【答案】氢、碳、铝 Al(CH3)3 Al(CH3)3+3HCl=AlCl3+3CH4↑ CH4+4CuO![]() 4Cu+CO2+2H2O 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 取甲中溶液少许,滴入KSCN溶液,若溶液显红色,则存在Fe3+;另取甲中溶液少许,稍加热,滴加酸性高锰酸钾,若紫色褪去(或颜色浅变淡),则说明有Fe2+。(或滴入K3Fe(CN)6溶液,若出现蓝色沉淀,则存在Fe2+)
4Cu+CO2+2H2O 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 取甲中溶液少许,滴入KSCN溶液,若溶液显红色,则存在Fe3+;另取甲中溶液少许,稍加热,滴加酸性高锰酸钾,若紫色褪去(或颜色浅变淡),则说明有Fe2+。(或滴入K3Fe(CN)6溶液,若出现蓝色沉淀,则存在Fe2+)
【解析】
Ⅰ.化合物A与水反应生成气体B和白色固体E,白色固体E加热可生成白色固体F,白色固体E既能溶于NaOH溶液又能溶于盐酸,说明E具有两性,则E为Al(OH)3,F为Al2O3,则化合物A中含有Al元素,1.02g Al2O3的物质的量为![]() =0.01mol,根据原子守恒,化合物A中的Al元素的物质的量为0.02mol,标准状况下,气体B的密度是氢气的8倍,根据摩尔质量之比等于密度之比,则B的摩尔质量为8×2g/mol=16g/mol,B在足量氧气中燃烧生成的气体C能与Ca(OH)2反应生成白色沉淀,则B为CH4气体,则化合物A中应含有C元素,CH4与足量的氧气完全燃烧生成气体C,C与足量氢氧化钙溶液反应生成白色沉淀D,则D为碳酸钙,6g碳酸钙的物质的量为
=0.01mol,根据原子守恒,化合物A中的Al元素的物质的量为0.02mol,标准状况下,气体B的密度是氢气的8倍,根据摩尔质量之比等于密度之比,则B的摩尔质量为8×2g/mol=16g/mol,B在足量氧气中燃烧生成的气体C能与Ca(OH)2反应生成白色沉淀,则B为CH4气体,则化合物A中应含有C元素,CH4与足量的氧气完全燃烧生成气体C,C与足量氢氧化钙溶液反应生成白色沉淀D,则D为碳酸钙,6g碳酸钙的物质的量为![]() =0.06mol,根据碳原子守恒,则化合物A中的碳元素物质的量为0.06mol,化合物A中第三种元素的质量=1.44g-0.02mol×27g/mol-0.06mol×12g/mol=0.18g,结合物料守恒,化合物A和水反应生成CH4和Al(OH)3,则化合物A中的第三种元素应为H元素,其物质的量为
=0.06mol,根据碳原子守恒,则化合物A中的碳元素物质的量为0.06mol,化合物A中第三种元素的质量=1.44g-0.02mol×27g/mol-0.06mol×12g/mol=0.18g,结合物料守恒,化合物A和水反应生成CH4和Al(OH)3,则化合物A中的第三种元素应为H元素,其物质的量为![]() =0.18mol,则n(H): n(Al): n(C)=0.18mol:0.02mol:0.06mol=9:1:3,根据化合物中元素的正负化合价代数和为零,则可得化合物A的化学式为Al(CH3)3,据此分析解答。
=0.18mol,则n(H): n(Al): n(C)=0.18mol:0.02mol:0.06mol=9:1:3,根据化合物中元素的正负化合价代数和为零,则可得化合物A的化学式为Al(CH3)3,据此分析解答。
Ⅱ.(1)实验过程中,甲中溶液三价铁离子具有氧化性,含有铁离子的溶液为黄色,二氧化硫具有还原性,向甲中通入二氧化硫,发生氧化还原反应生成亚铁离子,含亚铁离子的溶液呈浅绿色,故由黄色变为浅绿色;酸性条件下,硝酸根具有氧化性,可将亚铁离子氧化为铁离子,立即又变为黄色;
(2)反应后甲溶液中的阳离子可能为铁离子或亚铁离子,铁离子能使含有硫氰根离子的溶液变红,亚铁离子具有还原性,据此设计检验方法。
Ⅰ.(1)根据分析,组成 A 的三种元素是氢、碳、铝,A 的化学式是Al(CH3)3;
(2)固体A是Al(CH3)3,与足量稀盐酸反应生成氯化铝和甲烷,化学方程式是Al(CH3)3+3HCl=AlCl3+3CH4↑;
(3)气体 B 为CH4,CH4中的碳为-4价,为碳元素的最低价态,具有还原性,CuO具有氧化性,则CH4与足量 CuO 在加热条件下发生氧化还原反应,可能的化学方程式为CH4+4CuO![]() 4Cu+CO2+2H2O;
4Cu+CO2+2H2O;
Ⅱ.(1)实验过程中,甲中溶液三价铁离子具有氧化性,含有铁离子的溶液为黄色,二氧化硫具有还原性,向甲中通入二氧化硫,发生氧化还原反应生成亚铁离子(反应为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+),含亚铁离子的溶液呈浅绿色,故由黄色变为浅绿色,溶液呈酸性;酸性条件下,硝酸根具有氧化性,可将亚铁离子氧化为铁离子,立即又变为黄色,溶液由浅绿色变为黄色的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(2)由于反应中未指明反应用量,反应后甲溶液中的阳离子可能为铁离子或亚铁离子,铁离子能使含有硫氰根离子的溶液变红,亚铁离子具有还原性,检验反应后甲溶液中的金属阳离子方法为取甲中溶液少许,滴入KSCN溶液,若溶液显红色,则存在Fe3+;另取甲中溶液少许,稍加热,滴加酸性高锰酸钾,若紫色褪去(或颜色浅变淡),则说明有Fe2+。(或滴入K3Fe(CN)6溶液,若出现蓝色沉淀,则存在Fe2+)。

 阅读快车系列答案
阅读快车系列答案