题目内容
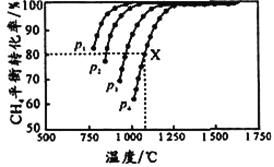
【题目】下列实验事实所引出的相应结论正确的是
选项 | 实验事实 | 结论 |
A[ | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参加化学反应 |
C | H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒在不同环境下反应 | 反应开始时速率相同 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
A. A B. B C. C D. D
【答案】AC
【解析】
反应物浓度增大,反应速率加快;催化剂参与反应,改变反应的途径;金属与反应时,氢离子浓度相同,则速率相同;容积缩小一倍,压强增大,正逆反应速率均增大。
其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需要的时间越短,是因反应物浓度增大,反应速率加快,A正确;催化剂参与反应,改变反应的途径,但反应前后其质量和化学性质不变,B错误;金属与反应时,氢离子浓度相同,则反应速率相同,反应开始时,盐酸和醋酸的氢离子浓度相同,则反应开始时速率相同,C正确;容积缩小一倍,压强增大,所以正逆反应速率均增大,故D错误。
故选AC。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】I、乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图的装置制备乙酸乙酯。
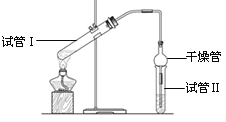
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:_____________。
(2)请写出用CH3CH218OH制备乙酸乙酯的化学方程式:_____________,反应类型为_______。
(3)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验 编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中的试剂 | 有机层的厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
②分析实验_________________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(4)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________(用百分数表示,保留一位小数)。
II、已知乳酸的结构简式为![]() 。试回答:
。试回答:
①乳酸分子中的官能团有:_____________________________________(写名称);
②乳酸与足量金属钠反应的化学方程式为________________________________;
③已知—COOH不会发生催化氧化,写出加热时,乳酸在Cu作用下与O2反应的化学方程式:________________________________________________;
④腈纶织物产泛地用作衣物、床上用品等。腈纶是由CH2=CH-CN聚合而成的。 写出在催化剂、加热条件下制备腈纶的化学方程式________________________。