题目内容
13.已知:A、B、C、D四种化合物分子中的电子数均为10,它们的沸点A>B>C>D.请回答下列问题:
(1)X分子与A分子的组成元素相同,但X分子中的电子数比A分子多8个,则X分子的电子式为
 .
.(2)C分子能与A分子通过氢键结合成弱碱,在低温下可析出一种分子晶体,该晶体的分子式为NH3.H2O.
(3)C分子与B分子反应,在常温下能形成固体化合物,该化合物属于离子 (填离子或共价)化合物.
(4)D是一种可持续发展的清洁能源,有人设想将其应用于燃料电池,该电池的导电液宜采用NaOH溶液,请写出该燃料电池的总反应离子方程式CH4+2O2+2OH-=CO32-+3H2O.
(5)请用中学化学实验室可能有的仪器和药品,设计将D应用于燃料电池,画出简单的实验装置图(包括仪器,药品,正、负电极材料,检流计,导线等)
分析 A、B、C、D四种化合物分子中的电子数均为10,它们的沸点A>B>C>D,A为H2O、B为HF、C为NH3、D为CH4.
(1)X分子与A分子的组成元素相同,但X分子中的电子数比A分子多8个,则X为H2O2;
(2)氨气分子与水分子之间形成氢键,在低温下可析NH3.H2O;
(3)C分子与B分子反应,在常温下能形成固体化合物为NH4F;
(4)甲烷燃烧生成二氧化碳与水,碱性条件下,生成二氧化碳与氢氧化钠反应生成碳酸钠;
(5)可以用氢氧化钠溶液作电解液,用石墨作电极,在两极分别通入甲烷与氧气,用短线连接成闭合回路.
解答 解:A、B、C、D四种化合物分子中的电子数均为10,它们的沸点A>B>C>D,A为H2O、B为HF、C为NH3、D为CH4.
(1)X分子与A分子的组成元素相同,但X分子中的电子数比A分子多8个,则X为H2O2,电子式为 ,故答案为:
,故答案为: ;
;
(2)氨气分子与水分子之间形成氢键,结合成弱碱一水合氨,在低温下可析NH3.H2O,
故答案为:氢键;NH3.H2O;
(3)C分子与B分子反应,在常温下能形成固体化合物为NH4F,属于离子化合物,
故答案为:离子;
(4)甲烷燃烧生成二氧化碳与水,碱性条件下,生成二氧化碳与氢氧化钠反应生成碳酸钠,电池总反应离子方程式为:CH4+2O2+2OH-=CO32-+3H2O,
故答案为:CH4+2O2+2OH-=CO32-+3H2O;
(5)可以用氢氧化钠溶液作电解液,用石墨作电极,在两极分别通入甲烷与氧气,用短线连接成闭合回路,实验装置图为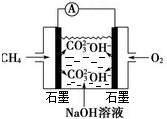 ,
,
故答案为: .
.
点评 本题考查无机物推断,注意识记常见10电子、18电子微粒,(5)中装置图为易错点,注意理解原电池原理,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)C、G两元素的最高价氧化物对应水化物相互反应的离子方程是:Al(OH)3+OH-=AlO2-+2H2O
(2)在一定条件下,A与E可形成化合物的化学式是NH3,其水溶液呈碱性(填“酸”、“碱”或“中”).
(3)写出A与F形成化合物的电子式 ,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)在一定条件下,A与E可形成化合物的化学式是NH3,其水溶液呈碱性(填“酸”、“碱”或“中”).
(3)写出A与F形成化合物的电子式
 ,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
8.有Wn+、Xm+、Ym-、Zn-(m>n)四种主族元素离子,且W、X、Y、Z四种原子的M电子层中的电子数均为奇数.下列说法中正确的是( )
| A. | Wn+、Xm+、Ym-、Zn-的离子半径依次增大 | |
| B. | Y、Z的气态氢化物的热稳定性:HmY>HnZ | |
| C. | W、X、Y、Z的最高价氧化物对应的水化物都是强电解质 | |
| D. | W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
18.可逆反应:2NO3$\stackrel{△}{?}$2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态.
(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态.
| A. | (1)(4) | B. | (2)(3) | C. | (1)(3)(4) | D. | (1)(2)(3)(4) |
5.在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是( )
| A. | AlCl3 | B. | Na2SO3 | C. | KMnO4 | D. | MgSO4 |
2.下列关于元素周期表的说法正确的是( )
| A. | 在元素周期表中,每一列就是一个族 | |
| B. | 主族元素都是短周期元素 | |
| C. | 副族元素都是金属元素 | |
| D. | 元素周期表每个长周期包含32种元素 |
3.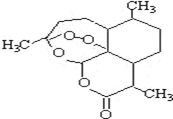 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H22O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 该化合物中含有过氧键,一定条件下有氧化性 | |
| D. | 青蒿素易溶于水 |
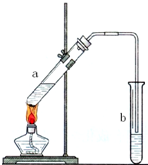 可用图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:
可用图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空: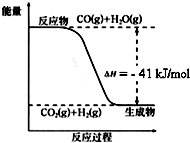 已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.
已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.