题目内容
(11分)工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH="
-1025" KJ/mol
4NO(g)+6H2O (g) ΔH="
-1025" KJ/mol
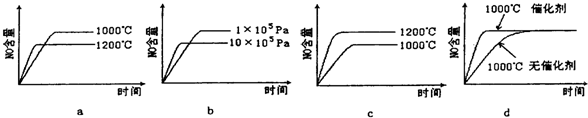
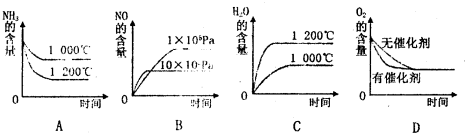
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
|
起始 |
0.8 |
1.5 |
0 |
|
第2min |
0.7 |
a |
0.1 |
|
第4min |
0.4 |
1.0 |
0.4 |
|
第6min |
0.4 |
1.0 |
0.4 |
|
第8min |
1.2 |
2.5 |
0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为 mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数 (填“增大”、“减小”或“不变”)
(3)室温下,将第一次达到平衡时的混合气体通入水中,然后向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中,溶液中水的电离平衡将 (填“正向”“ 逆向”或“不”)移动,所滴加氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数Kb=2×10-5 mol·L-1)
1)ad(2分)
(2)①增加氨气的转化率(1分) ②0.1875(1分)
③ab(2分) ④增加反应物浓度(1分),变小(1分)
(3)逆向(1分), 1/500b (2分)
【解析】
试题分析:判断一个可逆反应是否达到平衡有两个标志:一是正逆反应速率相等,二是各组分的浓度不再变化。在恒温恒压条件下,只要保证体积不变则达到平衡,反应物NH3、O2转化率不变也能说明达到平衡。合成氨工业中O2成本较NH3成本低,因此增大O2用量,提高NH3转化率。化学平均反应速率表达式:△v(A)="△c(A)/△t" ,②中简单计算省略。起始到第2minNH3的平均反应速率为0.05mol?L-1?min-1,而第2min到第4minNH3平均反应速率为0.15mol?L-1?min-1,反应速率明显加快。此反应为放热反应,加入催化剂或升高温度都将加快反应速率,经计算得O2的量并未增大,因此③选择ab。④中第8minC(NH3)增大3倍,C(O2)增大2.5倍,反应物NH3有剩余,NO的体积分数将减小。
考点:化学反应速率,影响化学平衡条件
点评:。本题结合化学平衡的标志,以及化学反应速率的实验及计算来考查,还联系了化学反应平衡常数的计算,题目信息量较大,但是大题小做,把每个小题分解到不同的化学知识点上来解题。

工业制硝酸的主要反应是:4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填字母序号)。
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填字母序号)。
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是_______________________________。