题目内容
工业制硝酸的主要反应是4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-akJ/mol(a>0)
(1)如图将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8a kJ,则反应时转移的电子数为 mol.
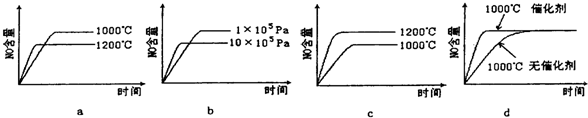
(2)若其他条件不变,下列关系图中错误的是 (选填序号)
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
①反应在第2min到第4min时,反应速率v(O2)= .
②第2min时改变了条件,改变的条件可能是 .
A.升高温度B.使用了催化剂C.减小压强D.增加了生成物
③在相同的温度下,起始向容器中加入NH、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向 方向进行(填“正反应”、“逆反应”、“不移动”).
(4)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其他损失),现有一定量的NO2经过 次循环操作后,才能使95%以上的NO2转化为HNO3.
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl或MgCl2作吸水剂的原因是 .
(1)如图将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8a kJ,则反应时转移的电子数为
(2)若其他条件不变,下列关系图中错误的是

(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
| 浓度 时间 |
c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.4 | 0 | 0 |
| 第2min | 3.2 | 1 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
②第2min时改变了条件,改变的条件可能是
A.升高温度B.使用了催化剂C.减小压强D.增加了生成物
③在相同的温度下,起始向容器中加入NH、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向
(4)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其他损失),现有一定量的NO2经过
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl或MgCl2作吸水剂的原因是
分析:(1)根据转移电子和放出热量之间的关系式计算;
(2)A.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动;
B.增大压强,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向气体体积减小的方向移动;
C.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动;
D.使用催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动;
(3)①先根据v=
计算一氧化氮的反应速率,再根据同一可逆反应中,同一时间段内,各元素的反应速率之比等于其计量数之比确定氧气的反应速率;
②先分析图表,再根据外界对化学平衡的影响分析;
③根据浓度商与化学平衡常数的相对大小判断移动方向;
(4)根据等比数列计算前n项和,再根据其转化率公式计算;
(5)盐酸易挥发导致硝酸中含有氯化氢.
(2)A.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动;
B.增大压强,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向气体体积减小的方向移动;
C.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动;
D.使用催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动;
(3)①先根据v=
| △C |
| △t |
②先分析图表,再根据外界对化学平衡的影响分析;
③根据浓度商与化学平衡常数的相对大小判断移动方向;
(4)根据等比数列计算前n项和,再根据其转化率公式计算;
(5)盐酸易挥发导致硝酸中含有氯化氢.
解答:解:(1)将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,根据氧气和放出热量的关系式知,参加反应的氧气的物质的量=
=4mol,根据氧气和转移电子之间的关系式得,转移电子的物质的量=
=16mol,故答案为:16;
(2)A.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动,氨气的含增大,故A错误;
B.增大压强,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向气体体积逆反应方向移动,则一氧化氮的含量减少,故B正确;
C.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向逆反应方向移动,则水的含量减少,故C错误;
D.使用催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动,则氧气的含量不变,故D正确;
故选AC;
(3)①反应在第2min到第4min时,反应速率v(NO)=
mol/(L.min)=0.6mol/(L.min),同一可逆反应中,同一时间段内,各元素的反应速率之比等于其计量数之比确定氧气的反应速率,则v(O2)=
mol/(L.min)=0.75mol/(L.min),故答案为:0.75mol/(L.min);
②根据生成物第2min及第4min时物质的量浓度的变化量知,第2min到第4min时反应速率增大,且平衡向正反应方向移动,则第2min时改变了条件,升高温度或使用催化剂,故选AB;
③第6min时,各种物质的浓度不变,说明该反应达到平衡状态,化学平衡常数K=
=3.0,
Q=
=1<3,则平衡向正反应方向移动,故答案为:正反应;
(4)设起始时NO2物质的量为1 mol,经过n次循环后生成HNO3的物质的量为:Sn=
+
×
+
×(
)2+??????+
×(
)n-1,经等比数列求和得Sn=
=1-(
)n,因此,NO2→HNO3转化率为
×100%,
×100%=95%,因此,n=2.6≈3,要经过3次循环操作才能使95%的NO2转化为HNO3,
故答案为:3;
(5)防止生成易挥发的HCl混入硝酸中,导致得到的硝酸不纯,故答案为:防止生成易挥发的HCl混入硝酸中.
| 0.8kJ×5mol |
| 1kJ |
| 4mol×20mol |
| 5mol |
(2)A.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动,氨气的含增大,故A错误;
B.增大压强,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向气体体积逆反应方向移动,则一氧化氮的含量减少,故B正确;
C.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向逆反应方向移动,则水的含量减少,故C错误;
D.使用催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动,则氧气的含量不变,故D正确;
故选AC;
(3)①反应在第2min到第4min时,反应速率v(NO)=
| 2.0-0.8 |
| 2 |
| 0.6×5 |
| 4 |
②根据生成物第2min及第4min时物质的量浓度的变化量知,第2min到第4min时反应速率增大,且平衡向正反应方向移动,则第2min时改变了条件,升高温度或使用催化剂,故选AB;
③第6min时,各种物质的浓度不变,说明该反应达到平衡状态,化学平衡常数K=
| (2.0)4.(3.0)6 |
| (2.0)4.(3.0)5 |
Q=
| 14.16 |
| 14.15 |
(4)设起始时NO2物质的量为1 mol,经过n次循环后生成HNO3的物质的量为:Sn=
| 2 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| ||||
1-
|
| 1 |
| 3 |
1-(
| ||
| 1 |
1-(
| ||
| 1 |
故答案为:3;
(5)防止生成易挥发的HCl混入硝酸中,导致得到的硝酸不纯,故答案为:防止生成易挥发的HCl混入硝酸中.
点评:本题考查了化学平衡的影响因素、氧化还原反应等知识点,涉及等比数列的运用,结合数学知识来分析解答,难点是计算循环次数及反应方向的判断,难度中等.

练习册系列答案
相关题目
工业制硝酸的主要反应是:4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填字母序号)。
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填字母序号)。
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是_______________________________。