题目内容
(2009?静安区一模)工业制硝酸的主要反应是:4NH3(g)+502(g)?4NO(g)+6H20(g)+1025KJ.
(1)该反应的平衡常数表达式为K=
;升高温度K值
(2)若反应物起始的物质的量相同,下列关系图错误的是

(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
①起始时物料比c(02):c(NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为
③反应在第2min改变了反应条件,改变的条件可能是
a.使用催化剂 b.升高温度 c.增大压强 d.增加02的浓度
④该反应通常在800℃时进行,主要原因是
⑤反应在第8min改变的反应条件可能是
(1)该反应的平衡常数表达式为K=
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |
减小
减小
(填“增大”、“减小”或“不变”).(2)若反应物起始的物质的量相同,下列关系图错误的是
C
C
(填序号).
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | O |
| 第2min | 0.6 | a | O.2 |
| 第4min | O.3 | 0.975 | O.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | O.5 |
增大氨气的转化率
增大氨气的转化率
.②反应在第2min到第4min时O2的平均反应速率为
0.1875
0.1875
(mol/L?min);③反应在第2min改变了反应条件,改变的条件可能是
a、b
a、b
(填序号)a.使用催化剂 b.升高温度 c.增大压强 d.增加02的浓度
④该反应通常在800℃时进行,主要原因是
该温度下催化剂的活性最大
该温度下催化剂的活性最大
.⑤反应在第8min改变的反应条件可能是
增大反应物的浓度
增大反应物的浓度
.分析:(1)根据平衡常数的概念以及温度对化学平衡平衡常数的影响;
(2)根据温度、压强、催化剂对化学反应速率以及平衡的影响;
(3)①根据增加一种物质的浓度,可以提高另一种物质的转化率;
②先根据速率公式求出NO的速率,然后根据速率之比等于化学计量数之比求出O2的速率;
③根据表可知第2min是平衡建立过程,反应速率加快,氧气的量没有增加,根据外界条件对化学反应速率的影响;
④根据催化剂的活性温度;
⑤根据改变瞬间生成物的浓度不变,反应物的浓度增大.
(2)根据温度、压强、催化剂对化学反应速率以及平衡的影响;
(3)①根据增加一种物质的浓度,可以提高另一种物质的转化率;
②先根据速率公式求出NO的速率,然后根据速率之比等于化学计量数之比求出O2的速率;
③根据表可知第2min是平衡建立过程,反应速率加快,氧气的量没有增加,根据外界条件对化学反应速率的影响;
④根据催化剂的活性温度;
⑤根据改变瞬间生成物的浓度不变,反应物的浓度增大.
解答:解:(1)平衡常数K=
=
,根据反应4NH3(g)+502(g)  4NO(g)+6H20(g)+1025KJ,可知反应是放热反应,随着温度的升高,平衡逆向移动,K减小,
4NO(g)+6H20(g)+1025KJ,可知反应是放热反应,随着温度的升高,平衡逆向移动,K减小,
故答案为:
;减小;
(2)a、温度升高,化学反应速率加快,缩短到达平衡的时间,平衡逆向移动,NO的物质的减少,故a正确;
b、压强增大化学反应速率加快,缩短到达平衡的时间,平衡向平衡逆向移动,NO的物质的减少,故b正确;
c、温度升高,化学反应速率加快,缩短到达平衡的时间,平衡逆向移动,NO的物质的减少,所以C错误,
d、使用催化剂,化学反应速率加快,但平衡不移动,故d正确;
故选:c.
(3)①因增加一种物质的浓度,可以提高另一种物质的转化率,所以合成氨中往往增加氧气的浓度来提高氨气的转化率,故答案为:增大氨气的转化率;
②第2min到第4min时NO的平均反应速率
=0.15mol/L?min,V(O2)=
V(NO)=0.1875mol/L?min,故答案为:0.1875;
③根据表可知第2min是平衡建立过程,反应速率加快,氧气的量没有增加,根据外界条件对化学反应速率的影响,可知使用催化剂、升高温度均可,增加02的浓度是不可,增大压强会使的各物质浓度增大,也不可,故选:a、b;
④在该温度下催化剂的活性最大,故答案为:该温度下催化剂的活性最大;
⑤因改变瞬间生成物的浓度不变,反应物的浓度增大,所以只能通过增大NH3和02的浓度来达到,故答案为:增大反应物的浓度.
| 生成物平衡浓度系数次方的乘积 |
| 反应物平衡浓度系数次方的乘积 |
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |
 4NO(g)+6H20(g)+1025KJ,可知反应是放热反应,随着温度的升高,平衡逆向移动,K减小,
4NO(g)+6H20(g)+1025KJ,可知反应是放热反应,随着温度的升高,平衡逆向移动,K减小,故答案为:
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |
(2)a、温度升高,化学反应速率加快,缩短到达平衡的时间,平衡逆向移动,NO的物质的减少,故a正确;
b、压强增大化学反应速率加快,缩短到达平衡的时间,平衡向平衡逆向移动,NO的物质的减少,故b正确;
c、温度升高,化学反应速率加快,缩短到达平衡的时间,平衡逆向移动,NO的物质的减少,所以C错误,
d、使用催化剂,化学反应速率加快,但平衡不移动,故d正确;
故选:c.
(3)①因增加一种物质的浓度,可以提高另一种物质的转化率,所以合成氨中往往增加氧气的浓度来提高氨气的转化率,故答案为:增大氨气的转化率;
②第2min到第4min时NO的平均反应速率
| O.3mol/L |
| 2min |
| 5 |
| 4 |
③根据表可知第2min是平衡建立过程,反应速率加快,氧气的量没有增加,根据外界条件对化学反应速率的影响,可知使用催化剂、升高温度均可,增加02的浓度是不可,增大压强会使的各物质浓度增大,也不可,故选:a、b;
④在该温度下催化剂的活性最大,故答案为:该温度下催化剂的活性最大;
⑤因改变瞬间生成物的浓度不变,反应物的浓度增大,所以只能通过增大NH3和02的浓度来达到,故答案为:增大反应物的浓度.
点评:本题主要考查了的知识点较多,是一道综合题,难度较大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
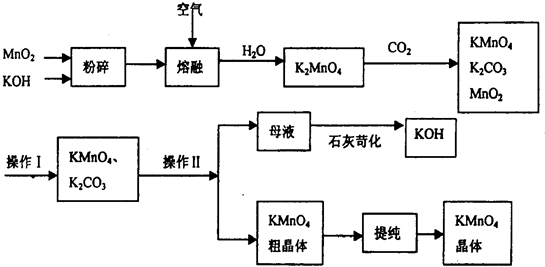
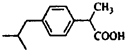
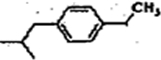

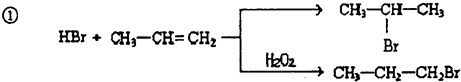
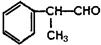 的物质,该物质是一种香料.
的物质,该物质是一种香料.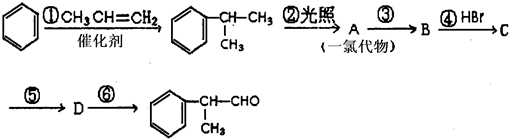
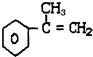 .
.
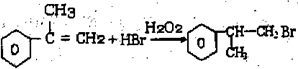
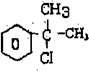 的水解产物
的水解产物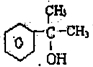 不能经氧化反应⑥得到产品
不能经氧化反应⑥得到产品