题目内容
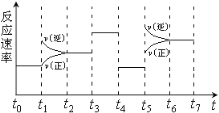
【题目】在密闭容器内发生反应:3FeO(s)+H2O![]() Fe3O4(s)+H2(g)-Q,H2O和H2物质的量随时间的变化如图所示,2min时仅改变一个条件,改变的条件是
Fe3O4(s)+H2(g)-Q,H2O和H2物质的量随时间的变化如图所示,2min时仅改变一个条件,改变的条件是

A. 减少n(H2O)B. 增加n(H2)C. 增大压强D. 升高温度
【答案】D
【解析】
由图可知,2min时,曲线斜率变大,则反应速率增大,且水的物质的量减小,氢气的物质的量增大,平衡正向移动,以此解答该题。
A.减少n(H2O),平衡逆向移动,反应速率减小,氢气的物质的量应该减小,A错误;
B.增加n(H2),平衡逆向移动,水的物质的量应增大,B错误;
C.反应前后气体的气体不变,增大压强,平衡不移动,气体的物质的量不变,C错误;
D.正反应吸热,升高温度,平衡正向移动,与图象相符合,D正确;
故合理选项是D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
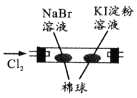
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D