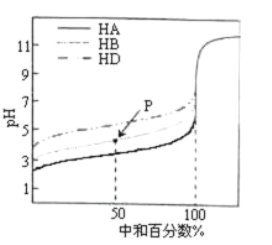
题目内容
【题目】按要求填空:
(1)实验室用加热二氧化锰和浓盐酸制氯气,离子方程式为____________________。若生成标准状况下2.24 L Cl2,则被氧化的HCl的物质的量为 _______________。
(2)向淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式为_______________________________________。
(3)①乙醇 ②MgCl2晶体 ③蔗糖 ④铜 ⑤食盐水 ⑥BaSO4 ⑦次氯酸
以上物质中属于电解质的是(填序号)_____________________________________。
(4)在甲、乙两个烧杯中,分别含有下列离子中的三种:Cu2+、Na+、H+、SO42-、CO32-、OH-。已知甲烧杯中的溶液呈蓝色,则乙烧杯中的溶液中大量存在的离子是_____________________。
【答案】MnO2+4H+ +2Cl-![]() Mn2+ +Cl2↑+2H2O 0.2mol Cl2+2I=2Cl+I2 ②⑥⑦ Na+、CO32-、OH-
Mn2+ +Cl2↑+2H2O 0.2mol Cl2+2I=2Cl+I2 ②⑥⑦ Na+、CO32-、OH-
【解析】
(1)实验室用加热二氧化锰和浓盐酸制氯气,离子方程式为:MnO2+4H+ +2Cl-![]() Mn2+ +Cl2↑+2H2O;生成标准状况下2.24 L Cl2,即0.1molCl2,则被氧化的HCl的物质的量为0.2mol;
Mn2+ +Cl2↑+2H2O;生成标准状况下2.24 L Cl2,即0.1molCl2,则被氧化的HCl的物质的量为0.2mol;
(2)向淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,说明有I2生成,故反应的离子方程式为:Cl2+2I=2Cl+I2;
(3)电解质:在水溶液或熔融状态下能发生电离的化合物。由此可知,属于电解质的是:②⑥⑦;
(4)甲烧杯中的溶液呈蓝色,说明甲烧杯中含有Cu2+,因Cu2+与CO32-、OH-不能大量共存,故溶液中的阴离子为SO42-,故乙烧杯中的溶液中大量存在的离子是Na+、CO32-、OH-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案