题目内容
【题目】用滴有氯化钠溶液的湿润的滤纸分别做甲、乙两个实验,下列判断正确的是
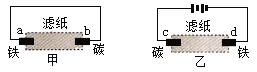
A. a极上发生还原反应
B. 铁片腐蚀速率:乙>甲
C. d为阴极,发生的反应为:Fe-2e→Fe2+
D. b极上发生的反应为:O2 + 2H2O + 4e → 4OH—
【答案】D
【解析】
甲是原电池,乙是电解池。
A.甲中铁为原电池的负极,Fe-2e-= Fe2+, a极上发生氧化反应,故A错误;
B.甲中铁为原电池的负极,Fe-2e-= Fe2+,乙中铁为电解池的阴极,发生反应2H++2e-=H2↑,铁被保护,故B错误;
C.d为阴极,发生的反应为:2H++2e-=H2↑,故C错误;
D.甲中铁发生吸氧腐蚀,b为正极,正极上的电极反应式为O2 + 2H2O + 4e → 4OH—,故D正确。
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:
Na2SO3+S+5H2O![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6gNa2SO3于100mL烧杯中,加50mL去离子水搅拌溶解。
②另取4.0g硫粉于200mL烧杯中,加6mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉网小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中,_________________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为__________________________。
(4)滤液中除Na2S2O3 和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00g产品(硫代硫酸钠晶体的摩尔质量为248g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/LI2的标准溶液滴定,反应的离子方程式为:2S2O32-+I2=S4O62-+2I-,记录数据如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.30 | 21.32 |
2 | 0.36 | 22.56 |
3 | 0.10 | 21.08 |
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3 常用于脱氯剂,在溶液中易被Cl2 氧化为SO42-,该反应的离子方程式为 _____________________________。

