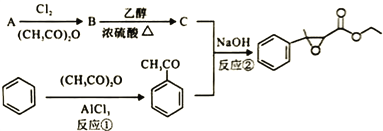
题目内容
【题目】氰化氢(HCN)是形成生物重要化合物的重要源或中间体,其水溶液称氢氰酸,是一种非常弱的酸。工业上以甲烷和氨气为原料在高温和催化剂的作用下按下列反应制备HCN:
2CH4(g)+3O2(g)+2NH3(g)![]() 2HCN(g)+6H2O(g) △H1=-475kJ/mol①
2HCN(g)+6H2O(g) △H1=-475kJ/mol①
CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H2=+240kJ/mol②
HCN(g)+3H2(g) △H2=+240kJ/mol②
(1)该条件下1mol水蒸气分解为氢气和氧气的热化学方程式为________________________(数值保留三位有效数字)。根据题中信息_______________(填“能”或“不能”)计算出氢气的燃烧热。
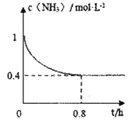
(2)在恒温恒容的密闭容器中按照体积比6:5的比例充入甲烷和氨气发生反应②,氨气的物质的量浓度与时间关系如图所示,从开始到0.8h达平衡状态的过程中v(H2)=____________________;甲烷的平衡转化率为____________;该温度下反应②的平衡常数K=________________________。
(3)工业生产中反应②常用铂作催化剂,甲、乙两名同学在讨论催化剂的选择,甲同学认为用铂作催化剂会提高生产成本,应研究出更廉价的催化剂;乙同学认为使用铂不会明显提高生产成本。你认为观点更合理的是___________(填“甲”或“乙”),原因是______________________________。
(4)HCN及其盐均有剧毒,因此含CN-的工业废水必须经过处理才能排放,处理方法之一是电解氧化法;以石墨为阳极、铁板为阴极电解含CN-的碱性废水,将CN-转化为N2和CO2。该方法的阳极反应式为___________________________。为确保CN-被完全处理掉,电解一段时间后通常会加入适量氯化钠固体,其作用可能是_____________________________。
【答案】 H2O(g)=1/2O2(g)+H2(g) △H=+159kJ/mol 不能 2.25 mol·L-1·h-1 50% 14.58 mol2·L-2 乙 生产过程中催化剂不报耗 2CN--10e-+8OH-=N2+2CO2+4H2O 增强溶液的导电能力
【解析】氰化氢(HCN)是形成生物重要化合物的重要源或中间体,其水溶液称氢氰酸,是一种非常弱的酸。工业上以甲烷和氨气为原料在高温和催化剂的作用下按下列反应制备HCN:
(1) 2CH4(g)+3O2(g)+2NH3(g)![]() 2HCN(g)+6H2O(g) △H1=-475kJ/mol①;CH4(g)+NH3(g)
2HCN(g)+6H2O(g) △H1=-475kJ/mol①;CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H2=+240kJ/mol②。由(②
HCN(g)+3H2(g) △H2=+240kJ/mol②。由(②![]() ①)
①)![]() 可得H2O(g)= H2(g)+
可得H2O(g)= H2(g)+ ![]() O2(g),△H=[+240kJ/mol
O2(g),△H=[+240kJ/mol![]() (-475kJ/mol)]
(-475kJ/mol)]![]() +159kJ/mol,所以,该条件下1mol水蒸气分解为氢气和氧气的热化学方程式为H2O(g)= H2(g)+
+159kJ/mol,所以,该条件下1mol水蒸气分解为氢气和氧气的热化学方程式为H2O(g)= H2(g)+ ![]() O2(g) △H=+159kJ/mol。因为不知道水蒸气变成液态水的热效应,根据题中信息不能计算出氢气的燃烧热。
O2(g) △H=+159kJ/mol。因为不知道水蒸气变成液态水的热效应,根据题中信息不能计算出氢气的燃烧热。
(2)在恒温恒容的密闭容器中按照体积比6:5的比例充入甲烷和氨气发生反应②CH4(g)+NH3(g)![]() HCN(g)+3H2(g),由图可知,从开始到0.8h达平衡状态的过程中氨气的浓度从1mol/L减少到0.4mol/L,氨气的变化量为0.6mol/L,则氢气的变化量为1.8mol/L,v(H2)=
HCN(g)+3H2(g),由图可知,从开始到0.8h达平衡状态的过程中氨气的浓度从1mol/L减少到0.4mol/L,氨气的变化量为0.6mol/L,则氢气的变化量为1.8mol/L,v(H2)=![]() 2.25 mol·L-1·h-1;由氨气的起始量可以求出甲烷的起始量为1.2mol/L,变化量与氨气相同,也是0.6mol/L,所以甲烷的平衡转化率为50%;该温度下反应②的平衡常数K=
2.25 mol·L-1·h-1;由氨气的起始量可以求出甲烷的起始量为1.2mol/L,变化量与氨气相同,也是0.6mol/L,所以甲烷的平衡转化率为50%;该温度下反应②的平衡常数K=![]() 14.58 mol2·L-2。
14.58 mol2·L-2。
(3)工业生产中反应②常用铂作催化剂,甲、乙两名同学在讨论催化剂的选择,甲同学认为用铂作催化剂会提高生产成本,应研究出更廉价的催化剂;乙同学认为使用铂不会明显提高生产成本。两种观点更合理的是乙,原因是生产过程中催化剂不报耗。
(4)以石墨为阳极、铁板为阴极电解含CN-的碱性废水,由题意可知,在阳极上CN-被氧化为N2和CO2,阳极的电极反应式为2CN--10e-+8OH-=N2+2CO2+4H2O。为确保CN-被完全处理掉,电解一段时间后,溶液中的离子浓度减小,故其导电性减弱,通常会加入适量氯化钠固体,以增强溶液的导电能力,提高电解效率。

【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。