题目内容
3.用NA代表阿伏加德罗常数的数值,下列说法不正确的是( )| A. | 14g13 C2H2所含的电子数为7NA | |
| B. | 0.5mol NO与0.5mol O2混合后所含的分子数小于0.75NA | |
| C. | 常温下,1L pH=3的Al2(SO4)3溶液中,水电离出的H+数为10-3NA | |
| D. | 在Na2SO3+Cl2+H20═Na2SO4+2HCl的反应中,若1.12L Cl2反应完全,则转移的电子数为0.1NA |
分析 A、1mol的13 C2H2所含电子为14mol,据此回答;
B、0.5mol NO与0.5molO2混合后发生的反应为2NO+O2═2NO2,2NO2?N2O4;
C、pH=3的Al2(SO4)3溶液中铝离子水解导致溶液显示酸性,根据水的离子积表达式计算;
D、Na2SO3+Cl2+H20═Na2SO4+2HCl的反应中,消耗1mol氯气,转移电子是2mol,据此计算.
解答 解:A、1mol的13 C2H2所含电子为14mol,14g13 C2H2所含的电子数为$\frac{14g}{28g/mol}$×14NA=7NA,故A正确;
B、0.5mol NO与0.5mol O2混合后发生的反应为2NO+O2═2NO2,2NO2?N2O4,则反应后的气体的物质的量小于0,75mol,混合后所含分子数目小于0.75NA,故B正确;
C、温下,1L pH=3的Al2(SO4)3溶液中,铝离子水解导致溶液显示酸性,氢离子全部来自水的电离,其浓度10-3mol/L.所以水电离出的H+数为10-3NA,故C正确;
D、Na2SO3+Cl2+H20═Na2SO4+2HCl的反应中,消耗1mol氯气,转移电子是2mol,若标况下1.12L 即0.05molCl2反应完全,则转移的电子数才是0.1NA,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意掌握标况下气体摩尔体积的使用条件,明确物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系.

练习册系列答案
相关题目
14.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液导电性变化较大的是( )
| A. | 0.5mol/L盐酸 | B. | 自来水 | ||
| C. | 0.5mol/L硫酸 | D. | 0.5mol/L 氢氧化钡 |
11.对于某些离子的检验及结论一定正确的是( )
| A. | 向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32- | |
| B. | 向某溶液中加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,则原溶液中一定有Ag+ | |
| C. | 向某溶液中先加入盐酸酸化,没有明显现象,再加入BaCl2溶液,有白色沉淀产生,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液一定有Ba2+ |
4.碳的化合物与人类生产、生活密切相关.
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表.
则该温度下反应的平衡常数K=$\frac{2}{3}$.
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2molH2,此时v(正)=v(逆),则x、y的关系式是x:y=3:1.
Ⅱ.在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180-200℃}^{50-80℃}$Ni(CO)4(g),则△H<0,(填“>”、“<”);缩小容器容积,平衡向右(填“左”或“右”)移动,△H不变(填“增大”、“减少”或“不变”,下同),混合气体的密度增大.
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表.
| T/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1 | 0.8 | 0.65 | 0.6 | 0.6 |
| n(CO)/mol | 0.8 | 0.6 | 0.45 | 0.4 | 0.4 |
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2molH2,此时v(正)=v(逆),则x、y的关系式是x:y=3:1.
Ⅱ.在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180-200℃}^{50-80℃}$Ni(CO)4(g),则△H<0,(填“>”、“<”);缩小容器容积,平衡向右(填“左”或“右”)移动,△H不变(填“增大”、“减少”或“不变”,下同),混合气体的密度增大.
9.(1)三硝酸甘油酯[C3H5(ONO2)3]是一种炸药,可因撞击而爆炸,同时产生高温.爆炸按下式进行:4C3H5(ONO2)3→wN2+xCO2+yH2O+zO2(式中w,x,y,z为化学计量数).当1mol三硝酸甘油酯爆炸并恢复到标准状况时,所得气体的体为106.4L.
(2)如表给出部分物质在不同温度下的溶解度:
分离食盐和纯碱混合物的最佳温度是0℃;若将含少量食盐的纯碱制成高温下的饱和溶液,当调节到最佳分离温度时,结晶析出的物质主要是碳酸钠.
(2)如表给出部分物质在不同温度下的溶解度:
| 温 度 | 0℃ | 10℃ | 20℃ | 30℃ |
| NaCl | 35.7g | 35.8g | 36.0g | 36.3g |
| NaHCO3 | 6.9g | 8.2g | 9.6g | 11.1g |
| Na2CO3•10H2O | 7.0g | 12.5g | 21.5g | 38.8g |
 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.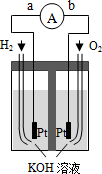 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: 直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.