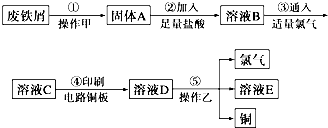
题目内容
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA |
分析 A、苯不是单双键交替的结构;
B、氢氧化钠溶液中,氢氧根离子抑制了水的电离,水中氢离子是水电离的;
C、燃料电池中正极发生还原反应,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应得到4mol电子;
D、SO2和O2的反应是可逆反应,不能进行彻底.
解答 解:A、苯不是单双键交替的结构,不含双键,故A错误;
B、pH=13的氢氧化钠溶液中氢氧根离子浓度为0.1mol/L,该溶液中氢离子浓度为:1×10-13mol/L,氢氧化钠溶液中的氢离子是水电离的,则水电离的氢氧根离子的物质的量为1×10-13mol,水电离的OH-离子数目为1×10-13NA,故B错误;
C、标况下22.4L气体的物质的量为1mol,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应转移了4mol电子,则电路中通过的电子数目为4NA,故C错误;
D、SO2和O2的反应是可逆反应,不能进行彻底,即不能彻底反应生成2molSO3,故混合气体的物质的量大于2mol,分子数大于2NA个,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.下列事实中,能用勒夏特列原理解释的是( )
| A. | 对于反应2HI(g)?H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 硫酸工业中,加催化剂有利于三氧化硫的生成 | |
| D. | 2SO2+O2$?_{加热}^{催化剂}$2SO3的反应条件不是室温,是500℃左右 |
8.下列变化可通过一步实验直接完成的是( )
| A. | Al(OH)3→Al2O3 | B. | Al2O3→Al(OH)3 | C. | Al→Al(OH)3 | D. | SiO2→H2SiO3 |
5.很多地区连日雾霾天气的罪魁祸首之一是PM2.5,2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标.下面关于PM2.5的说法中不正确的是( )
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物 | |
| B. | PM2.5只是地球大气成分中含量很少的组分,对空气质量和能见度等没什么影响 | |
| C. | PM2.5粒径小,富含大量的有毒、有害物质且在大气中的停留时间长、输送距离远 | |
| D. | PM2.5主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物等 |
12.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| B | 常温下将Fe片放入浓硝酸中 | 无明显变化 | Fe与浓硝酸不反应 |
| C | 将一小块Na放入医用酒精中 | 产生气泡 | Na只置换出醇羟基上的氢 |
| D | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
2.在碱性条件下能够大量共存,而在强酸性条件下却能发生氧化还原反应的离子组是( )
| A. | Ba2+、AlO2-、NO3-、Cl- | B. | K+、Na+、ClO-、Fe2+ | ||
| C. | Na+、I-、NO3-、SO42- | D. | NH4+、Na+、S2-、CO32- |
9.已知下表均为烷烃分子的化学式,且它们的一氯取代物只有一种
则第6项烷烃分子的化学式( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | C17H36 | … | … |
| A. | C16H34 | B. | C22H46 | C. | C26H54 | D. | C27H56 |
8.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用日图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管2,再测试管2中有机层的厚度,实验记录如下:
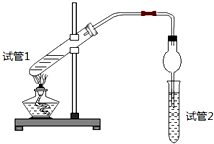 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH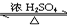 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(3)分析实验A(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH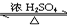 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(3)分析实验A(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.