题目内容
把一块镁铝合金投入到1 mol/L盐酸里,待合金完全溶解后,往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图A所示。下列说法中不正确的是( )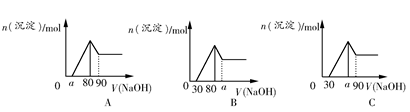
| A.a的取值范围为0≤a<50 |
B.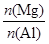 的最大值为2.5 的最大值为2.5 |
| C.若将关系图改为图B,则a的取值范围为80<a<90 |
| D.若将关系图改为图C,则a的取值范围为75<a<90 |
C
解析

练习册系列答案
相关题目
用装有NH3和空气的甲、乙、丙烧瓶分别做喷泉实验,实验结束后,甲、乙、丙烧瓶中溶液的体积依次为烧瓶体积的四分之三、一半和四分之一。若忽略溶质扩散,甲、乙、丙三个烧瓶中氨水的物质的量浓度之比约为
| A.1:1:1 | B.3:2:1 | C.1:2:3 | D.2:3:6 |
下列说法正确的是
| A.欲配制1.00L 1.00mol·L-1的NaCI溶液,可将58.5g NaC1溶于1.00L水中 |
| B.0.1mol Na2O2与足量水反应,转移电子数为0.2NA |
| C.同温同压下,质量相同的SO2气体和CO2气体的体积比等16:11 |
| D.1.0L 1.0mol ·L-l的NaAlO2水溶液中含有的氧原子数大于2NA |
设NA是阿伏加德罗常数的值,下列说法正确的是
| A.1 L1mol·L-1的NaClO溶液中含有ClO-的数目为NA |
| B.60g二氧化硅含有的共价键数为2NA |
| C.7.8g钾与100mL 1mol·L-1盐酸充分反应生成气体分子数为0.1NA |
| D.标准状况下,7.1g 氯气与足量的石灰乳充分反应,转移电子数为0.2NA |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.32g甲醇中含有C-H键的数目为4NA |
| B.1L0.1mol·L-1的氨水含有0.1NA个OH- |
| C.10L pH=1的硫酸溶液中含有的H+数为2NA |
| D.H2S和SO2气体混合生成0.3mol单质硫时,转移电子的数目为0.4NA |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.11.2 L N2所含分子数为0.5NA |
| B.常温下,16 g CH4中共用电子对的数目为4NA |
| C.一定温度下,1 mol FeCl3水解生成NA个Fe(OH)3胶体颗粒 |
| D.在反应H2O2+Cl2=2HCl+O2中,每生成32 g氧气,转移4NA个电子 |
在一定的温度和压强下,1体积X2(气)跟3体积Y2(气)化合生成2体积化合物(气),则该化合物的化学式是( )。
| A.XY3 | B.XY | C.X3Y | D.X2Y3 |
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
| A.H2O2分子中只存在极性键 |
B.NH3的结构式为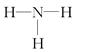 |
C.HCl的电子式为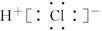 |
D.H2O的比例模型为 |