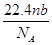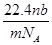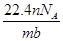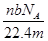题目内容
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.32g甲醇中含有C-H键的数目为4NA |
| B.1L0.1mol·L-1的氨水含有0.1NA个OH- |
| C.10L pH=1的硫酸溶液中含有的H+数为2NA |
| D.H2S和SO2气体混合生成0.3mol单质硫时,转移电子的数目为0.4NA |
D
解析试题分析:A、32g甲醇中含有C-H键的数目为3NA;B.一水合氨是弱碱,不能完全电离;C、10L pH=1的硫酸溶液中含有的H+数为NA;D、2H2S+SO2=3S+2H2O,生成3mol单质硫时有2mol是氧化产物,1mol是还原产物,生成0.3mol单质硫时,转移电子的数目为0.4NA。
考点:考查阿伏伽德罗常数。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
用NA表示阿伏加德罗数,下列叙述正确的是( )
| A.7.8gNa2O2固体中阴、阳离子数之和一定为0.3NA |
| B.室温下,14.0g乙烯和丁烯的混合气体中含有的氢原子数目为NA |
| C.0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| D.常温常压下,1mol甲基所含的电子总数为7 NA |
以NA代表阿伏加德罗常数的值,下列说法申正确的是
| A.9g18O2含有的中子数为5NA |
| B.标准状况下,0.5NABr2所占的体积约为11.2L |
| C.常温下,1L0.1mol·L-1NH4NO3溶液中含有的NH4+数为0.1NA |
| D.一定条件下,lmol N2和3mol H2在密闭容器充分反应,生成N-H键的数目为6NA |
将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.2mol?L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
| A.5.3g | B.10.6g | C.4.2g | D.3.1g |
把一块镁铝合金投入到1 mol/L盐酸里,待合金完全溶解后,往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图A所示。下列说法中不正确的是( )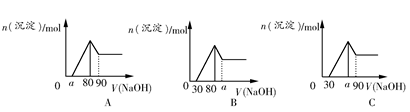
| A.a的取值范围为0≤a<50 |
B.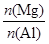 的最大值为2.5 的最大值为2.5 |
| C.若将关系图改为图B,则a的取值范围为80<a<90 |
| D.若将关系图改为图C,则a的取值范围为75<a<90 |
某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①该氯原子的相对原子质量为12a/b
②m g该氯原子的物质的量为m/(aNA)mol
③该氯原子的摩尔质量是aNA g
④a g该氯原子所含的电子数为17 mol
| A.①③ | B.②④ | C.①② | D.②③ |
下列指定微粒的数目相等的是( )
| A.物质的量相等的H2O与D2O含有的中子数 |
| B.20 mL NH3和30 mL O2所含的原子数 |
| C.等物质的量的Na2O和Na2O2中含有的阴离子总数 |
| D.等物质的量的钠和铜分别与氯气完全反应,转移的电子数 |
已知硫铁矿在沸腾炉中煅烧(4FeS2+11O2 8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )
8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )
| A.0.18 | B.0.12 | C.0.16 | D.0.20 |