题目内容
关于下列图示的说法正确的是

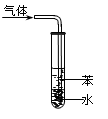


| A.图①表示石墨转变为金刚石是吸热反应 |
| B.图②所示实验可比较非金属性强弱:氯﹥碳﹥硅 |
| C.图③吸收NH3并防倒吸 |
| D.图④两装置中金属电极a、b都有气体产生,可判断金属活动性:a﹤b |
A
解析试题分析:A、石墨的能量低于金刚石,故石墨转化为金刚石为吸热反应,正确;B、只能说明HCl的酸性强于碳酸,不能说明Cl的非金属性比C强;C、气体直接进入水中故起不到防止倒吸的作用;D、左侧电池Zn为正极,故a更活泼,右侧电池b比Fe活泼,无法判断a、b的活泼性。
考点:考查化学反应与能量、非金属性强弱的比较、原电池原理、化学实验基础等知识。

练习册系列答案
相关题目
在下列各说法中,正确的是
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
下列变化为放热的化学反应的是 ( ) 
| A.H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1 |
| B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ·mol-1 |
| C.形成化学键时共放出862 kJ能量的化学反应 |
| D.能量变化如右图所示的化学反应 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)===CO2 (g);△H=-283.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热 |
强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)=H2O(l);△H=" -57.3k" kJ·mol-1,
又知在溶液中反应有:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ;△H= -Q1kJ·mol-1 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l) ;△H= -Q2 kJ·mol-1
Na2SO4(aq)+H2O(l) ;△H= -Q2 kJ·mol-1
HCl(aq)+NaOH(aq)="=" NaCl(aq)+H2O(l) ;△H= -Q3 kJ·mol-1,
则Q1、Q2、Q3的关系正确的是
| A.Q1 =Q2 = Q3 | B.Q2 > Q3 > Q1 | C.Q2 > Q1 > Q3 | D.Q2 = Q3 > Q1 |
下列反应中生成物总能量高于反应物总能量的是( )
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
已知如下两个热化学反应方程式:

下列说法不正确的是 ( )
| A.反应①、②都属于加成反应 |
| B.在通常条件下,反应①、②都能自发进行 |
| C.反应①吸热、反应②放热的事实说明苯环中含有的并不是碳碳双键 |
| D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
下列反应既是氧化还原反应又是放热反应的是( )
| A.过氧化钠与水反应 | B.氨水与稀硫酸的反应 |
| C.灼热的炭与CO2反应 | D.Ba(OH)2·8H2O与NH4Cl 的反应 |
某反应的反应过程中能量变化如图1 所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
| A.该反应为放热反应 |
| B.催化剂能改变该反应的焓变 |
| C.催化剂能降低该反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |