题目内容
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)===CO2 (g);△H=-283.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热 |
B
解析试题分析:A、中和热是指在稀溶液中,强酸与强碱的稀溶液完全反应生成1 mol H2O所放出的热量,所以H2SO4和Ca(OH)2反应的中和热也为ΔH="-57.3" kJ?mol-1,错误;B、根据燃烧热的概念判断;CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)===CO2 (g);△H=-283.0 kJ/mol,正确;C、需要加热才能发生的反应不一定是吸热反应,如铝热反应、碳的燃烧等,错误;D、燃烧热是指1 mol可燃物完全燃烧生成稳定的化合物所放出的热量,硫燃烧应生成气态二氧化硫,错误。
考点:考查化学反应中的能量变化,燃烧热、中和热的概念。

练习册系列答案
相关题目
下列依据相关数据作出的推理和判断中,不正确的是
| A.依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B.依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯 |
| C.依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D.依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
下列说法正确的是( )
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
下列反应属于吸热反应的是
| A.石灰石在高温下的分解反应 | B.生石灰和水的反应 |
| C.盐酸与氢氧化钠溶液的反应 | D.木炭在氧气中燃烧 |
酸碱中和反应 NaOH(?)+ HCl(?)→NaCl(?)+ H2O(?)+57.6 kJ中,问号表示的状态正确的是
| A.NaOH:固 | B.盐酸:液 | C.NaCl:溶液 | D.H2O:溶液 |
关于下列图示的说法正确的是



| A.图①表示石墨转变为金刚石是吸热反应 |
| B.图②所示实验可比较非金属性强弱:氯﹥碳﹥硅 |
| C.图③吸收NH3并防倒吸 |
| D.图④两装置中金属电极a、b都有气体产生,可判断金属活动性:a﹤b |
已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+ O2(g) ΔH=-266 kJ·mol-1
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
| A.CO的燃烧热为283 kJ |
| B.下图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532kJ·mol-1 |
| D.CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023 |

有关键能数据如下表所示: 
则晶体硅在氧气中燃烧的热化学方程式为 ;
;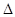 H="-989.2"
H="-989.2" 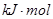
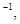 则x的值为 ( )
则x的值为 ( )
| A.460 | B.920 | C.1 165.2 | D.423.3 |
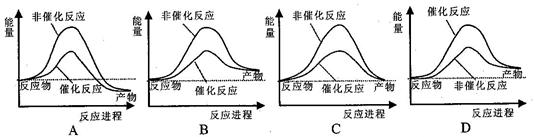
 2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是