题目内容
8.在密闭容器中进行X(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应中,其中X2、Y2、Z2、Q2的开始浓度分别为0.1mol/L、0.4mol/L、0.2mol/L、0.3mol/L,当反应达到平衡后,各物质的浓度不可能是( )| A. | c(X2)=0.15mol/L | B. | c(Y2)=0.9mol/L | C. | c(Z2)=0.3mol/L | D. | c(Q2)=0.5mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:A、X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应X2浓度增大,说明反应逆向进行建立平衡,所以0.1mol/L<c(X2)<0.2mol/L,故A不选;
B、X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应Y2浓度增大,说明反应逆向进行建立平衡,得到0.4mol/L<c(Y2)<0.8mol/L,故B选;
C、X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应Z2浓度增大,说明反应正向进行建立平衡,得到0.2mol/L<c(Z2)<0.4mol/L,故C不选;
D、X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应Q2浓度增大,说明反应正向进行建立平衡,得到0.3mol/L<c(Q2)<0.6mol/L,故D不选;
故选:B.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
18.在带有活塞的密闭容器中发生反应:Fe2O3+3H2═2Fe+3H2O,采取下列措施不能改变反应速率的是( )
| A. | 加热 | B. | 保持容器体积不变,增加H2输入量 | ||
| C. | 充入N2,保持容器内压强不变 | D. | 充入N2,保持容器体积不变 |
19.下列分离或提纯物质的方法正确的是( )
| A. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用渗析的方法精制Fe(OH)3胶体 | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
3.分子式为C7H14O2的有机物Q,在稀硫酸溶液加热可转化为乙醇与另一种酸性物质,则Q的结构最多有( )
| A. | 6种 | B. | 4种 | C. | 3种 | D. | 2种 |
20.某结晶水合物的化学式为R•nH2O,其相对分子质量为M.25℃时,a g该晶体能够溶于b g水中形成V mL溶液.下列关系中不正确的是( )
| A. | 该溶液中溶剂与溶质的质量比为m(水):m(溶质)=( $\frac{18na}{M}$+b):(a-$\frac{18na}{M}$) | |
| B. | 该溶液的物质的量浓度为c=$\frac{1000a}{MV}$mol•L-1 | |
| C. | 该溶液中溶质的质量分数为ω=$\frac{100a(M-18n)}{a+b}$% | |
| D. | 该溶液的密度为ρ=$\frac{1000(a+b)}{V}$g•L-1 |
17.下列变化需要加入还原剂才能实现的是( )
| A. | Cu→Cu2+ | B. | Cl-→Cl2 | C. | MnO4-→Mn2+ | D. | NH3→NO |




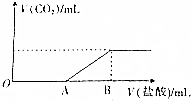 标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.
标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.