题目内容
下列物质的转化在给定条件下能实现的是( )
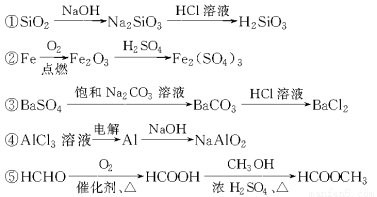
A.①④⑤
B.②③④
C.②④⑤
D.①③⑤
D
【解析】②中Fe在O2中燃烧的产物是Fe3O4;④中电解AlCl3溶液得到的是Al(OH)3。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
题目内容
下列物质的转化在给定条件下能实现的是( )

A.①④⑤
B.②③④
C.②④⑤
D.①③⑤
D
【解析】②中Fe在O2中燃烧的产物是Fe3O4;④中电解AlCl3溶液得到的是Al(OH)3。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案