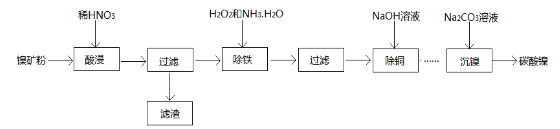
题目内容
【题目】2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕,一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO)等一碳化合物在化工、医药、能源等方面都有广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1mol HCHO过程中能量变化如图:
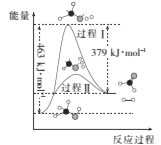
已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.5kJ/mol
则反应CO2(g)+2H2(g)=HCHO(g)+H2O(g) H=______kJ/mol
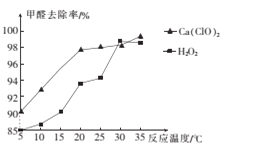
(2)氧化剂可处理甲醛污染,结合图象分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为____(填化学式)。
(3)纳米二氧化钛催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) H=akJ/mol
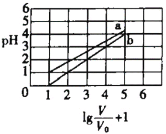
①按![]() =2投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。则a ___(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是______。
=2投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。则a ___(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是______。
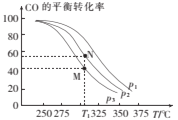
②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol/L。达到平衡时,CO的转化率为图中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为______(保留3位有效数字)。
(4)工业上利用CH4(混有CO和H2)与水蒸气在一定条件下制取H2,该反应的逆反应速率表达式为v逆=kc(CO)c3(H2),k为速率常数,在某温度下测得实验数据如表所示:
CO浓度(mol/L) | H2浓度(mol/L) | 逆反应速率(mol·L-1·min-1) |
0.1 | c1 | 8.0 |
c2 | c1 | 16.0 |
c2 | 0.15 | 6.75 |
由上述数据可得该温度下,c2=_____,该反应的逆反应速率常数k=____L3mol-3min-l。
(5)用甲醇可以制备甲胺(CH3NH2),甲胺在水中的电离方程式与氨相似。25℃时,甲胺的电离常数Ka=9.25×10-7。该温度下,反应CH3NH2+H+![]() CH3NH3+的平衡常数K= ___(填数值)。
CH3NH3+的平衡常数K= ___(填数值)。
【答案】+34.5 Ca(ClO)2 < p3<p2<p1 4.17 0.2 1.0×104 9.25×107
【解析】
(1)由图可知1molCH3OH分解为1molHCHO和1molH2需要吸收能量463 kJ/mol -379 kJ/mol =84 kJ/mol,所以图示反应的热化学方程式为i:CH3OH(g)=HCHO(g)+H2(g) H=84 kJ/mol,又已知ii: CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.5kJ/mol,由i+ii可得方程式CO2(g)+2H2(g)=HCHO(g)+H2O(g),根据盖斯定律可知该反应H=84 kJ·mol-1+(-49.5kJ/mol)=34.5 kJ/mol;
(2)分析图像可知,水温约为15℃时.选择Ca(ClO)2处理被甲醛污染的水源时,甲醛去除率更高;
(3)①据图可知相同压强下温度越高CO的平衡转化率越小,即温度升高平衡逆向移动,所以正反应为放热反应,所以H<0,即a<0;该反应正反应为气体体积减小的反应,所以相同温度下压强越大CO的平衡转化率越大,所以p3<p2<p1;
②平衡常数只与温度有关,温度不变则平衡常数不变,所以M点和N点平衡常数相等,M点CO的转化为40%,初始投料为2.0mol/L的H2和CO,则列三段式有:

该反应平衡常数![]() ;
;
(4)根据v逆=kc(CO)c3(H2),由表中数据可得:c13=![]() ,c2=
,c2= ,所以有
,所以有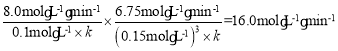 ,解得k=1.0×104L3·mol-3·min-3,带入c2的等式可得c2=0.2mol/L;
,解得k=1.0×104L3·mol-3·min-3,带入c2的等式可得c2=0.2mol/L;
(5)甲胺在水中的电离方程式与氨相似,所以其电离方程式为CH3NH2+H2O![]() CH3NH3++OH-,所以Ka=
CH3NH3++OH-,所以Ka=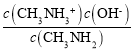 ,反应CH3NH2+H+
,反应CH3NH2+H+![]() CH3NH3+的平衡常数K=
CH3NH3+的平衡常数K=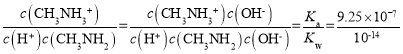 =9.25×107。
=9.25×107。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案