题目内容
【题目】NaNO2是一种白色或微黄色斜方晶体,易溶于水,微溶于乙醇。某校同学设计实验制备NaNO2并探究其性质。回答下列问题:
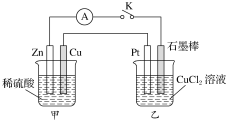
(1)甲组同学依据反应Na2CO3+NO+NO2=2NaNO2+CO2,并利用下列装置制备少量含NaNO2的溶液。(E中氧气稍过量)
A B
B![]() C
C![]() D
D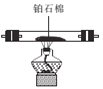 E
E![]() F
F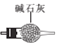
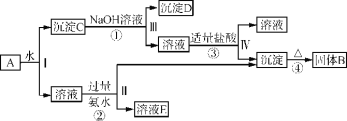
①正确的连接顺序:A—F—E— ___— ___—___ —尾气处理。(填字母)
②装置A的烧瓶中盛放的物质是____(填名称),C装置的作用是 ___。
(2)乙组同学依据反应Pb+NaNO3![]() NaNO2+PbO(难溶于水),并按下列实验流程制备NaNO2:
NaNO2+PbO(难溶于水),并按下列实验流程制备NaNO2:
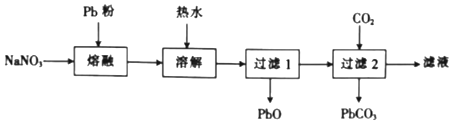
①“熔融”时用Pb粉代替铅粒的目的是____。
②由“过滤2”的滤液得到NaNO2晶体还需经过的具体操作为____、____、过滤、用乙醇洗涤后干燥。
(3)丙组同学探究NaNO2的性质,取少量乙组制得的NaNO2溶于水制得NaNO2溶液。
①取少量NaNO2溶液于试管中,滴入盐酸酸化,再加入KI和淀粉溶液,振荡,溶液变蓝,说明NaNO2具有____(填“氧化性”或“还原性”)。
②向酸性KMnO4溶液中滴入NaNO2溶液,溶液紫色逐渐褪去,发生反应的离子方程式为____(MnO4-被还原为Mn2+)。
【答案】D C B 生石灰(或碱石灰或固体氢氧化钠) 除去未反应完的NH3 增大与NaNO3的接触面积,加快反应速率 蒸发浓缩 冷却结晶 氧化性 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O
【解析】
由装置图可知:利用装置A制备NH3,用装置F中的碱石灰干燥后再在装置E中和氧气混合均匀,在装置D处在铂石棉的催化下发生催化氧化反应生成水和NO,NO在空气中和氧气反应又生成NO2,全部气体通入装置C中除去未反应完的NH3,然后通入装置B中,使其发生反应Na2CO3+NO+NO2=2NaNO2+CO2,据此解答。
(1)①利用装置A中浓氨水制备NH3,用装置F干燥后再在装置E中和氧气混合均匀,在装置D处发生催化氧化反应,全部气体通入装置C中除去未反应完的NH3,然后通入装置B中,使其发生反应Na2CO3+NO+NO2=2NaNO2+CO2,注意尾气用碱溶液吸收,结合气流方向,故装置的连接顺序为A→F→E→D→C→B→尾气处理;
②装置A中是快速制NH3的,用碱性可以吸收水分的药品即可以使浓氨水逸出NH3,所以可以选用生石灰(或碱石灰或固体氢氧化钠);制备少量NaNO2,需要比较纯净的NO和NO2,所以要用浓硫酸除去未反应完的NH3;
(2)①“熔融”时用Pb粉代替铅粒的目的是增大与液态NaNO3的接触面积,加快反应速率;
②由“过滤2”的滤液得到NaNO2晶体还需经过的具体操作为蒸发浓缩,冷却结晶,过滤、用乙醇洗涤后、干燥得到NaNO2晶体;
(3)①淀粉溶液变蓝,说明KI被氧化生成了单质碘,所以NaNO2具有氧化性;
②高锰酸酸钾具有强的氧化性,在酸性条件下与NaNO2发生氧化还原反应,生成NO3-和水,高锰酸根离子被还原为二价锰离子,结合电子守恒、电荷守恒可的离子方程式为5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O。

 阅读快车系列答案
阅读快车系列答案【题目】2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕,一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO)等一碳化合物在化工、医药、能源等方面都有广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1mol HCHO过程中能量变化如图:
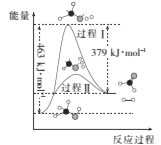
已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.5kJ/mol
则反应CO2(g)+2H2(g)=HCHO(g)+H2O(g) H=______kJ/mol
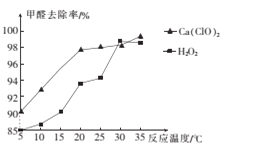
(2)氧化剂可处理甲醛污染,结合图象分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为____(填化学式)。
(3)纳米二氧化钛催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) H=akJ/mol
①按![]() =2投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。则a ___(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是______。
=2投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。则a ___(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是______。
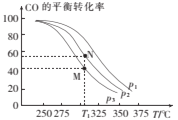
②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol/L。达到平衡时,CO的转化率为图中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为______(保留3位有效数字)。
(4)工业上利用CH4(混有CO和H2)与水蒸气在一定条件下制取H2,该反应的逆反应速率表达式为v逆=kc(CO)c3(H2),k为速率常数,在某温度下测得实验数据如表所示:
CO浓度(mol/L) | H2浓度(mol/L) | 逆反应速率(mol·L-1·min-1) |
0.1 | c1 | 8.0 |
c2 | c1 | 16.0 |
c2 | 0.15 | 6.75 |
由上述数据可得该温度下,c2=_____,该反应的逆反应速率常数k=____L3mol-3min-l。
(5)用甲醇可以制备甲胺(CH3NH2),甲胺在水中的电离方程式与氨相似。25℃时,甲胺的电离常数Ka=9.25×10-7。该温度下,反应CH3NH2+H+![]() CH3NH3+的平衡常数K= ___(填数值)。
CH3NH3+的平衡常数K= ___(填数值)。