题目内容
已知中学化学中常见反应形式为:A+B=C+D+H2O,对于该反应叙述不正确的是( )
分析:反应形式为:A+B=C+D+H2O的反应可以是:碳酸盐和盐酸之间的反应,金属和浓硝酸或是浓硫酸之间的反应,二氧化锰和浓盐酸加热制取氯气的反应等,根据氧化还原反应的概念来判断即可.
解答:解:A、反应MnO2+4HCl
MnCl2+Cl2↑+2H2O符合形式,是氧化还原反应,故A正确;
B、反应CaCO3+2HCl=CaCl2+CO2↑+H2O符合形式,是复分解反应,为非氧化还原反应,故B正确;
C、甲烷的不完全燃烧:4CH4+7O2
2CO2+2CO+8H2O符合形式,C、D都不属于盐类,故C错误;
D、反应CaCO3+2HCl=CaCl2+CO2↑+H2O符合形式,A和B不一定是酸和碱,故D正确.
故选C.
| ||
B、反应CaCO3+2HCl=CaCl2+CO2↑+H2O符合形式,是复分解反应,为非氧化还原反应,故B正确;
C、甲烷的不完全燃烧:4CH4+7O2
| 点燃 |
D、反应CaCO3+2HCl=CaCl2+CO2↑+H2O符合形式,A和B不一定是酸和碱,故D正确.
故选C.
点评:本题考查学生对化学反应的灵活掌握知识,可以根据所学知识来回答,要求学生灵活运用所学知识来解决问题,难度不大.

练习册系列答案
相关题目
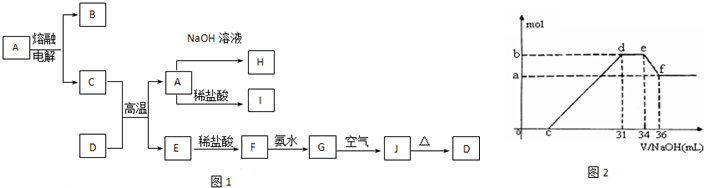
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。请回答下列问题:
 |
(1) A的化学式为
(2) H溶液中通入过量的CO2,其反应的离子方程式是
G→J的化学方程式为
(3) D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
(4) 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的C、E混合物 与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

① 图中o c段没有沉淀生成,此阶段发生反应的离子方程式为__________________________。
② 在d e段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式_______________ ;
上述现象说明溶液中_______结合OHˉ的能力最强(填离子符号)。
③ b与a的差值为_________mol。