题目内容
试分析以石墨为电极电解Cu(NO3)2溶液的原理。请试着写出⑴电极反应式; ⑵电解的总反应式和离子方程式。
⑴ 阳极 4OH- → 2H2O +O2↑+ 4e-;阴极 2 Cu2+ +4e- → 2 Cu 。⑵2Cu(NO3)2 + 2 H2O 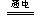 2 Cu +O2↑+ 4HNO3。2Cu2+ + 2 H2O
2 Cu +O2↑+ 4HNO3。2Cu2+ + 2 H2O 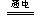 2 Cu +O2↑+ 4H+。
2 Cu +O2↑+ 4H+。
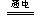 2 Cu +O2↑+ 4HNO3。2Cu2+ + 2 H2O
2 Cu +O2↑+ 4HNO3。2Cu2+ + 2 H2O 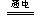 2 Cu +O2↑+ 4H+。
2 Cu +O2↑+ 4H+。Cu(NO3)2的水溶液中有Cu(NO3)2和H2O两种物质组成,而H2O电离出的H+和OH-中的OH-放电,在改写总化学方程式时,来自于H2O的OH-要改写作H2O。Cu(NO3)2的水溶液中Cu2+、H+两种阳离子和NO3-、OH-两种阴离子。Cu2+、H+在阴极上的的电子顺序是:Cu2+>H+(Cu2+氧化性比H+的强);OH-、NO3-在阳极上失电子顺序是:OH->NO3-(OH-还原性比NO3-强)。所以,电极反应式为:阳极 4OH- → 2H2O +O2↑+ 4e-;阴极 2 Cu2+ +4e- → 2 Cu 。将两个电极反应式相加,得到电解的总反应式为:2Cu(NO3)2 + 2 H2O  2 Cu +O2↑+ 4HNO3。
2 Cu +O2↑+ 4HNO3。
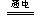 2 Cu +O2↑+ 4HNO3。
2 Cu +O2↑+ 4HNO3。
练习册系列答案
相关题目
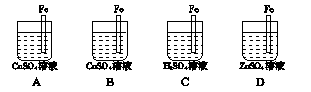
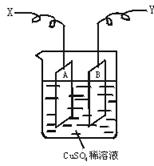
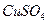 溶液时,通电一段时间后,向所得的溶液中加入0.1mol
溶液时,通电一段时间后,向所得的溶液中加入0.1mol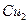 (
(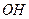 )
)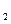
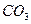 后恰好恢复到点解前的浓度和
后恰好恢复到点解前的浓度和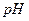 (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为
(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为