��Ŀ����
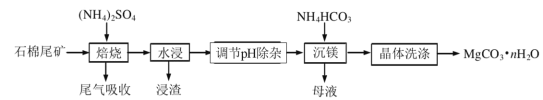
����Ŀ��ʯ��β����Ҫ����Mg3(Si2O5)(OH)��������Fe2O3��Al2O3����ʯ��β��ΪþԴ�Ʊ�̼��þ����(MgCO3��nH2O)�Ĺ�����ͼ��
��֪�������������е�����ӦΪ��Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3��+2SiO2+7H2O��+2SO3��
3MgSO4+10NH3��+2SiO2+7H2O��+2SO3��
��1��д�����ղ���NH3�ĵ���ʽ__��
��2��Ϊ���ˮ�����ʣ��ɲ�ȡ�Ĵ�ʩΪ__����дһ�����ɣ���������������Ҫ�ɷ�Ϊ___��
��3����������pH������ʱ����ȥ������������__�������£���Ҫ����Һ�е�c(Fe3+)������4.0��10-11mol/L����Ӧ������Һ��pH=___��Ksp[Fe(OH)3]=4.0��10-38����
��������pH������ʱ������ѡ�õ��Լ���___��
A��MgO B��NaOH C��MgCO3 D��HNO3
��4������þ�������з�Ӧ�����ӷ���ʽΪ___������þ��ʱ���¶ȳ���60�棬�������϶�ļ�ʽ̼��þ[Mg2(OH)2CO3]���ʣ�ԭ����__��
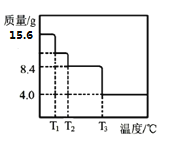
��5��ijС��ͬѧ��ȡ15.6gMgCO3��nH2O�������ط�����������ʣ������������¶ȱ仯��������ͼ��ʾ����n=__��
���𰸡�![]() �����պ����ù���������Ȼ���� SiO2 Fe3+��Al3+ 5 AC Mg2+��2HCO3-��(n-1)H2O=MgCO3nH2O����CO2�� ���´ٽ�Mg2+ˮ�⣨�����´ٽ�MgCO3��������ȫˮ�⣩ 4
�����պ����ù���������Ȼ���� SiO2 Fe3+��Al3+ 5 AC Mg2+��2HCO3-��(n-1)H2O=MgCO3nH2O����CO2�� ���´ٽ�Mg2+ˮ�⣨�����´ٽ�MgCO3��������ȫˮ�⣩ 4
��������
��ʯ��β��ΪþԴ�Ʊ�̼��þ����(MgCO3��nH2O)��ע����������Ҫ��ȥ���ʣ���������Fe2O3��Al2O3��
��1��Nԭ���������5�����ӣ���3��Hԭ�ӹ��õ��ӹ����ȶ���8���ӽṹ���� NH3�ĵ���ʽ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��2��Ϊ���ˮ�����ʣ��ɽ�������������߽��������������Һ��ĽӴ�������ʵ�����Ҳ�������ˮ�����ʣ��ʴ�Ϊ�������պ����ù���������Ȼ���裻������Ϣ��������ʱ����ӦΪ��Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3��+2SiO2+7H2O��+2SO3����
3MgSO4+10NH3��+2SiO2+7H2O��+2SO3����
������ֻ��SiO2������ˮ����Ϊ��������ȥ���ʴ�Ϊ��SiO2��
��3���ٱ����̵�Ŀ���ǣ�ʯ��β��ΪþԴ�Ʊ�̼��þ����(MgCO3��nH2O)��ˮ������Һ�д��ڵ�����������Fe3+��Al3+ ����Ҫ����pH���ӣ��ʴ�Ϊ��Fe3+��Al3+��
�����£���Ҫ����Һ�е�c(Fe3+)������4.0��10-11mol/L������ Ksp[Fe(OH)3]=4.0��10-38��֪Ksp[Fe(OH)3]= ![]() ���������ݣ����c(OH-)=1.0��10-9mol��L
���������ݣ����c(OH-)=1.0��10-9mol��L![]() ��c(H+)=1.0��10-9mol��L
��c(H+)=1.0��10-9mol��L![]() ��pH=5���ʴ�Ϊ��5��
��pH=5���ʴ�Ϊ��5��
��������pH������ʱ���轫pH����5��ȥFe3+��Al3+����ע�ⲻ���������ʣ�����ѡ�õ��Լ���MgO��MgCO3 ��Mg(OH)2 �ȣ��ʴ�Ϊ��AC��
��4������þ�������У�������֪�ں�Mg2+����Һ�м���HCO3-Ҫ����MgCO3nH2O������ͬʱ��CO2����ų������ӷ���ʽΪ��Mg2+��2HCO3-��(n-1)H2O=MgCO3nH2O����CO2��������þ��ʱ���¶ȳ���60���������¶ȴٽ�M g2+ˮ������Mg(OH)2��Mg(OH)2��CO2��Ӧ���ɵļ�ʽ̼��þ[Mg2(OH)2CO3]���ʣ��ʴ�Ϊ��Mg2+��2HCO3-��(n-1)H2O=MgCO3nH2O����CO2�������´ٽ�Mg2+ˮ�⣨�����´ٽ�MgCO3��������ȫˮ�⣩��
��5��ijС��ͬѧ��ȡ15.6gMgCO3��nH2O�������ط�����������ʣ������������¶ȱ仯��������ͼ��ʾ��MgCO3��nH2O���ȷֽ�����MgO��CO2��H2O������ʣ�������MgO��n(MgO)=![]() =0.1mol������þԭ���غ㣬n(MgO)= n(MgCO3)= n(MgCO3��nH2O) =0.1mol��m(MgCO3)=0.1��84g��mol
=0.1mol������þԭ���غ㣬n(MgO)= n(MgCO3)= n(MgCO3��nH2O) =0.1mol��m(MgCO3)=0.1��84g��mol![]() =8.4g��n(H2O)=
=8.4g��n(H2O)=![]() =0.4mol����n=4���ʴ�Ϊ��4��
=0.4mol����n=4���ʴ�Ϊ��4��