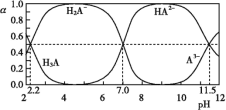
题目内容
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) N2(g)+CO2(g)。向容积均为l L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
0min | 40min | 80min | 120min | 160min | ||
甲 | T℃ | 2mol | 1.45 mol | 1 mol | 1 mol | 1 mol |
乙 | 400℃ | 2 mol | 1.5 mol | 1.1 mol | 0.8 mol | 0.8 mol |
丙 | 400℃ | 1 mol | 0.8 mol | 0.65 mol | 0.53 mol | 0.45 mol |
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____________________;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,l mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
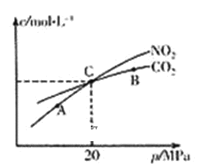
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为:_____________________。
【答案】> 6.25×103mol·L1·min1 0.4 A 4 2H2(g)+SO2(g)=S(g)+2H2O(g) △H=+90.4 kJ·mol-1
【解析】
(1)对比甲和乙,甲和乙初始时的组分的量相同,根据表中数据,在相同时间内,甲中反应物消耗的比乙多,则甲的反应速率更快,温度越高,化学反应速率越大;根据化学反应平均速率计算公式![]() 计算NO的化学反应平均速率,由化学反应速率之比等于化学计量数之比计算CO2的平均反应速率;根据等效平衡判断丙中NO的物质的量;
计算NO的化学反应平均速率,由化学反应速率之比等于化学计量数之比计算CO2的平均反应速率;根据等效平衡判断丙中NO的物质的量;
(2)①反应为2NO2(g)+2C(s)N2(g)+2CO2(g),随着反应的进行,气体分子数增加,体系总压强增大,压强增大,平衡向逆反应方向移动;
②根据图象,c点时体系总压为20MPa,此时平衡体系中c(CO2)=c(NO2),列出反应的三段式计算NO2、N2、CO2分压,进而反应的平衡常数Kp;
(3)H2(g)还原SO2(g)生成S(g)和H2O(g)的化学方程式为:2H2(g)+SO2(g)═S(g)+2H2O(g),该反应可由已知的热化学方程式推导,根据盖斯定律计算该反应的焓变。
(1)对比甲和乙,甲和乙初始时的组分的量相同,根据表中数据,在相同时间内,甲中反应物消耗的比乙多,则甲的反应速率更快,温度越高,化学反应速率越大,则甲容器反应温度T℃>400℃;根据乙容器的数据,040min内,反应经历的时间△t=40min,NO的物质的量改变量为△n(NO)=2mol1.5mol=0.5mol,容器体积为V=1L,则NO的平均速率为![]() ,由化学反应速率之比等于化学计量数之比可知,则040min内平均反应速率
,由化学反应速率之比等于化学计量数之比可知,则040min内平均反应速率![]() ;
;
根据反应方程式:2NO(g)+C(s)N2(g)+CO2(g),可知这是一个反应前后气体物质的量不变的反应,压强不对化学平衡产生影响,乙和丙两容器的容积、温度均相同,起始时乙容器中的NO的量是丙容器中的两倍,相当于乙容器是加压的,化学平衡不移动,则平衡时,两个容器中NO的转化率是一样的,这就是等效平衡的思想,乙中平衡时,n(NO)=0.8mol,自然丙平衡时n(NO)必然为0.4mol,
故答案为:>;6.25×103mol·L1·min1;0.4;
(2)①反应为2NO2(g)+2C(s)N2(g)+2CO2(g),随着反应的进行,气体分子数增加,体系总压强增大,压强增大,平衡向逆反应方向移动,所以总的来说,高压强对应低的NO2转化率,所以A、B、C三点中NO2的转化率最高的是A点;
故答案为:A;
②根据图象,c点时体系总压为20MPa,此时平衡体系中c(CO2)=c(NO2),反应的三段式为
2NO2(g)+2C(s)N2(g)+2CO2(g)
起始量 1 0 0
变化量 2x x 2x
平衡量 1-2x x 2x
平衡体系中c(CO2)=c(NO2),则12x=2x,x=0.25,NO2、N2、CO2分压分别为![]() ,同理,p(N2)=4Mpa,p(CO2)=8Mpa,则该反应的平衡常数为
,同理,p(N2)=4Mpa,p(CO2)=8Mpa,则该反应的平衡常数为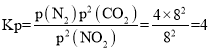 ;
;
故答案为:4;
(3)已知:①2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1;
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1;
则H2(g)还原SO2(g)生成S(g)和H2O(g)的化学方程式为:2H2(g)+SO2(g)═S(g)+2H2O(g),该反应可由①②+③得到,根据盖斯定律,则该反应的焓变为△H=△H1△H2+△H3=8.0 kJ/mol (566.0) kJ/mol +(483.6) kJ/mol =90.4kJ/mol;
故答案为:2H2(g)+SO2(g)=S(g)+2H2O(g) △H=+90.4 kJ·mol-1。

【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
II | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理________,哪些违反了洪特规则________。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(2)![]() 可用于制造火柴,其分子结构如图所示。
可用于制造火柴,其分子结构如图所示。

![]() 分子中硫原子的杂化轨道类型为________。
分子中硫原子的杂化轨道类型为________。
![]() 每个
每个![]() 分子中含有的孤电子对的数目为________。
分子中含有的孤电子对的数目为________。
(3)科学家合成了一种阳离子“![]() ”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“
”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“![]() ”的化学式为“
”的化学式为“![]() ”的离子晶体,其电子式为________。分子
”的离子晶体,其电子式为________。分子![]() 中键与键之间的夹角为
中键与键之间的夹角为![]() ,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为________________。
,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为________________。
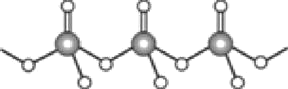
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为________。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径
碳酸盐 |
|
|
|
|
热分解温度 | 402 | 900 | 1172 | 1360 |
金属阳离子半径 | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是_____________。
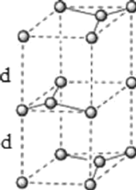
(6)石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为![]() ,
,![]() 键的键长为
键的键长为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则石墨晶体的层间距为________cm。
,则石墨晶体的层间距为________cm。
 。
。