题目内容
5.强热硫酸亚铁固体可反应:FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$FexOy+SO2↑+O2↑+SO3↑(未配平),则下列有关判断不正确的是( )| A. | 若所得气体中SO2与O2的体积比为2:1,则FexOy为氧化亚铁 | |
| B. | 若所得FexOy为氧化铁,则气体中SO2与O2的体积比大于2:1 | |
| C. | 若所得FexOy为Fe3O4,则气体中SO2与O2的体积比为3:2 | |
| D. | 生成的混合气通入BaCl2溶液中,产生的沉淀为BaSO4 |
分析 A.若所得气体中SO2与O2的体积比为2:1,由得失电子守恒和原子守恒配平方程式,据此分析;
B.若所得FexOy为氧化铁,则Fe、O的化合价升高,S元素的化合价降低,根据得失电子守恒分析;
C.若所得FexOy为Fe3O4,由得失电子守恒和原子守恒配平方程式,再判断产物;
D.二氧化硫溶于水生成的亚硫酸易被氧气氧化为硫酸.
解答 解:A.若所得气体中SO2与O2的体积比为2:1,由得失电子守恒和原子守恒配平方程式:3FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$3FeO+2SO2↑+O2↑+SO3↑,则FexOy为氧化亚铁,故A正确;
B.若所得FexOy为氧化铁,则Fe、O的化合价升高失电子,S元素的化合价降低得电子,若气体中SO2与O2的体积比等于2:1,则得失电子恰好相等,由于Fe元素也失电子,所以SO2与O2的体积比应该大于2:1,故B正确;
C.若所得FexOy为Fe3O4,由得失电子守恒和原子守恒配平方程式为6FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3O4+4SO2↑+O2↑+2SO3↑,则气体中SO2与O2的体积比为4:1,故C错误;
D.二氧化硫溶于水生成的亚硫酸易被氧气氧化为硫酸,三氧化硫溶于水生成硫酸,硫酸与BaCl2溶液反应生成硫酸钡沉淀,故D正确.
故选C.
点评 本题考查了氧化还原反应,侧重于氧化还原反应电子转移和方程式的配平的考查,题目难度中等,考查了学生对基础知识的应用能力.

练习册系列答案
相关题目
16.以下反应能发生的是( )
| A. | Cu+FeSO4═Fe+CuSO4 | B. | 2HCl+Na2SO4═H2SO4+2NaCl | ||
| C. | CaCO3+2HCl═CaCl2+CO2↑+H2O | D. | 2Ag+2HCl═2AgCl↓+H2↑ |
13.有FeO、Fe2O3的混合物若干克,在足量氢气中加热充分反应,冷却后称得剩余固体比原混合物减轻了8克;将等质量的原混合物与盐酸反应,欲使之完全溶解,需1mol/L的盐酸的体积至少为( )
| A. | 0.5L | B. | 0.1L | C. | 2L | D. | 1L |
20.下列对容量瓶及其使用方法的描述正确的是( )
| A. | 使用前要检查容量瓶是否漏水 | |
| B. | 容量瓶上标明了规格、温度和浓度 | |
| C. | 容量瓶用蒸馏水洗净后,要烘干水分后才能使用 | |
| D. | 配制好溶液后,要在容量瓶上贴上标签,保存备用 |
10.100g浓度为13.6mol/LHNO3(ρ>1g/ml )中加入A g水,浓度变为 6.8mol/L,则加入水的体积( )
| A. | >100 mL | B. | =100 mL | C. | <100 mL | D. | 不能确定 |
19.下列说法错误的是( )
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙酸分子中含有羧基,乙酸的酸性比碳酸弱 | |
| C. | 乙醇、乙酸都能发生酯化反应 | |
| D. | 只用水就能鉴别苯和四氯化碳 |


 ,G的结构简式为
,G的结构简式为 .
. +2CH3OH$?_{△}^{浓H_{2}SO_{4}}$
+2CH3OH$?_{△}^{浓H_{2}SO_{4}}$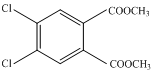 +2H2O.
+2H2O. .
.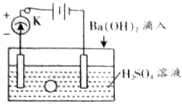 如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电能力的关系装置图.
如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电能力的关系装置图. 氯乙烷跟化合物之间的转化如图所示:
氯乙烷跟化合物之间的转化如图所示: