题目内容
17.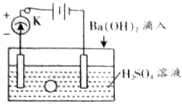 如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电能力的关系装置图.
如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电能力的关系装置图.首先在水槽中加入200mL 2mol•L-1的H2SO4溶液,同时将一个表面光滑的小球放入容器中,小球悬浮在溶液中央,闭合开关K,电流计发生偏转,然后进行以下操作,请回答下列问题.
(1)向溶液中滴加与H2SO4溶液密度相同的Ba(OH)2溶液至反应完全,观察到的现象是:小球下沉、溶液中有白色沉淀生成,电流计偏转角度减小,当两种溶液恰好反应时电流计偏转角度为0,电流计指针的偏转程度减小,当二者恰好反应时,电流计偏转程度为0,小球下沉,反应的离子方程式是2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O.
(2)把Ba(OH)2溶液换成密度相同的以下两种溶液(设反应后的体积为两溶液的体积和)
A.BaCl2 B.Na2SO4
①滴加A的过程中,观察到的现象是:有白色沉淀,电流计偏转角度减小但不为0,小球下沉,电流计指针的偏转程度减小但不为0,小球下沉,反应的化学方程式是H2SO4+BaCl2=BaSO4↓+2HCl.
②滴加B的过程中,小球在溶液中的相对位置不变,电流计指针的偏转程度不变.
分析 (1)向H2SO4溶液中滴加与H2SO4溶液密度相同的Ba(OH)2溶液至反应完全,发生的反应为H2SO4+Ba(OH)2=BaSO4↓+2H2O,溶液由硫酸溶液转化为水,溶液密度减小,溶液中离子浓度降低,溶液导电能力减小;
(2)①向溶液中加入BaCl2溶液至反应完全,发生的反应为H2SO4+BaCl2=BaSO4↓+2HCl,溶液密度减小,离子浓度减小;
②向溶液中加入Na2SO4溶液,二者不反应,离子浓度不变,溶液密度不变.
解答 解:(1)向H2SO4溶液中滴加与H2SO4溶液密度相同的Ba(OH)2溶液至反应完全,发生的离子反应方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,随着氢氧化钡的滴入,溶液中离子的浓度逐渐减小、溶质逐渐减少,导电能力减弱、密度减小,当两种溶液恰好完全反应时,溶液中几乎没有自由移动的离子,所以电流计偏转程度逐渐减小,最后为零,小球下沉,
故答案为:小球下沉、溶液中有白色沉淀生成,电流计偏转角度减小,当两种溶液恰好反应时电流计偏转角度为0;减小,当二者恰好反应时,电流计偏转程度为0;下沉;2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(2)①加入BaCl2时,发生的反应为H2SO4+BaCl2=BaSO4↓+2HCl,有白色沉淀产生,同时有盐酸生成,溶液体积增大,导致自由离子浓度减少,溶质的浓度减小,溶液密度减小,所以看到的现象是:产生白色沉淀,电流计偏转程度逐渐减小,但不为零,小球下沉,
故答案为:有白色沉淀,电流计偏转角度减小但不为0,小球下沉;减小但不为0;下沉;H2SO4+BaCl2=BaSO4↓+2HCl;
②向溶液中加入Na2SO4溶液,二者不反应,离子浓度不变,溶液密度不变,所以没有明显现象,
所以小球在溶液中的相对位置不变,电流计指针的偏转程度不变,故答案为:不变;不变.
点评 本题考查元素化合物性质及离子反应、溶液导电性等知识点,为高频考点,明确导电性与离子浓度关系是解本题关键,知道小球是否下沉与溶液密度有关,题目难度不大.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. | 利用核磁共振氢谱图可鉴别1-溴丙烷和2-溴丙烷 | |
| B. | 有机物的同系物具有相同的最简式 | |
| C. | 石油和煤都是混合物,但通过化学方法石油分馏出的汽油是纯净物 | |
| D. | 煤中含有煤焦油及多种化工原料,可通过物理方法煤的干馏获得 |
| A. | 若所得气体中SO2与O2的体积比为2:1,则FexOy为氧化亚铁 | |
| B. | 若所得FexOy为氧化铁,则气体中SO2与O2的体积比大于2:1 | |
| C. | 若所得FexOy为Fe3O4,则气体中SO2与O2的体积比为3:2 | |
| D. | 生成的混合气通入BaCl2溶液中,产生的沉淀为BaSO4 |
| A. | 随着电解的进行,溶液的pH减小 | |
| B. | 0H-向阳极移动,阳极附近溶液呈碱性 | |
| C. | NO3-向阳极移动,Na+向阴极移动,分别在对应的电极上放电 | |
| D. | 阴极上H+得电子被还原成H2,使阴极附近的溶液呈碱性 |
| A. | 氯离子的结构示意图: | |
| B. | 甲基的电子式: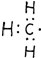 | |
| C. | Na+的电子排布图: | |
| D. | 硫离子的核外电子排布式:1S22S22P63S23P6 |