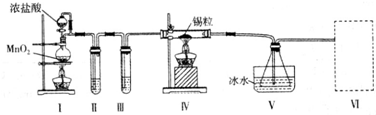
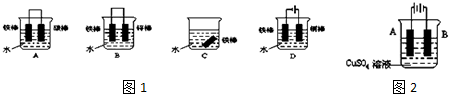
题目内容
10.100g浓度为13.6mol/LHNO3(ρ>1g/ml )中加入A g水,浓度变为 6.8mol/L,则加入水的体积( )| A. | >100 mL | B. | =100 mL | C. | <100 mL | D. | 不能确定 |
分析 设出原硝酸溶液体积及稀释后溶液体积,然后根据反应前后浓度变化计算出稀释前后溶液体积关系;硝酸溶液浓度越大,则硝酸溶液的密度越大,据此判断需要加入水的质量及体积.
解答 解:设原硝酸溶液的体积为VmL,根据稀释前后溶质的质量不变,设稀释后溶液的体积为x,
则:VmL×13.6mol/L=x×6.8mol/L,
解得:x=2VmL,
硝酸溶液的浓度越大,密度越大,所以稀释后硝酸的密度小于ρ,故稀释后硝酸的质量小于2V×ρ(即200g),所以加入水的质量小于:200g-100g=100g,
故加入水的体积小于 $\frac{100g}{1g/mL}$=100mL,
故选C.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,注意掌握物质的量浓度的概念及计算方法,试题充分考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列有关化学与生活、生产的叙述错误的是( )
| A. | 用作“钡餐”的物质主要成分是硫酸钡 | |
| B. | 采用催化设施,将汽车尾气中CO和NO转化为无害气体 | |
| C. | SO2具有还原性,可用于漂白纸浆 | |
| D. | 常温下,可以用铁制容器来盛装冷的浓硫酸 |
5.强热硫酸亚铁固体可反应:FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$FexOy+SO2↑+O2↑+SO3↑(未配平),则下列有关判断不正确的是( )
| A. | 若所得气体中SO2与O2的体积比为2:1,则FexOy为氧化亚铁 | |
| B. | 若所得FexOy为氧化铁,则气体中SO2与O2的体积比大于2:1 | |
| C. | 若所得FexOy为Fe3O4,则气体中SO2与O2的体积比为3:2 | |
| D. | 生成的混合气通入BaCl2溶液中,产生的沉淀为BaSO4 |
15.下列反应属于一种元素还原两种元素的是( )
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | |
| B. | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2(FeS2中S为-1) | |
| C. | HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2(HgS中S为-2价) | |
| D. | 2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑ |
2.下列关于电解NaNO3溶液的叙述正确的是( )
| A. | 随着电解的进行,溶液的pH减小 | |
| B. | 0H-向阳极移动,阳极附近溶液呈碱性 | |
| C. | NO3-向阳极移动,Na+向阴极移动,分别在对应的电极上放电 | |
| D. | 阴极上H+得电子被还原成H2,使阴极附近的溶液呈碱性 |
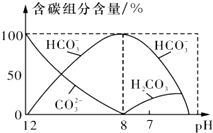 (1)一定温度下,向1L 0.l mol•L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-}).c(H{+}^)}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”).
(1)一定温度下,向1L 0.l mol•L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-}).c(H{+}^)}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”).