题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1molNa2O2所含的离子总数是0.4NA
B.0.1mol的11B中,含有0.6NA个中子
C.常温常压下,124gP4中所含P—P键数目为4NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
【答案】B
【解析】
A.Na2O2有Na+和O22-构成,0.1molNa2O2所含的离子总数是0.3NA,A错误;
B.一个11B含11-5=6个中子,故0.1mol的11B中,含有0.6NA个中子,B正确;
C.P4为正四面体结构,1mol P4含6molP-P键,124gP4的物质的量=![]() =1mol,故124gP4中所含P—P键数目为6NA,C错误;
=1mol,故124gP4中所含P—P键数目为6NA,C错误;
D.SO2和O2的反应为可逆反应,可逆反应有限度,2molSO2和1molO2催化反应后分子总数小于2NA,D错误。
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
(查阅资料)① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O![]() Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式: ____Cu2++ ____SO32-+ ____ =____Cu2O↓+ ____ + ____HSO3-
(实验探究)
操作 | 现象 |
| i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______。
(5)iii中砖红色沉淀消失的原因是_______。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______、_______。
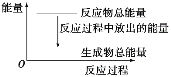
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是____________
a.反应速率 v( NH3) =v( N2) b.容器内压强不再随时间而发生变化 c.容器内 N2 的物质的量分数不再随时间而发生变化 d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6 e.12molN-H 键断裂的同时生成 5mol N≡N 键 f.混合气体的总质量不随时间的变化而变化
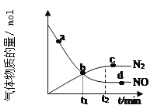
②某次实验中测得容器内 NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆) (填﹥、﹤或﹦)。
(2) 已知:N≡N的键能为946kJ/mol, H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则N2与H2反应,生成1mol NH3过程中______(填“吸收”或“放出”)的能量为_______kJ。
(3) 一定条件下,在 5 L密闭容器内,反应 2NO2(g) ![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用 N2O4 表示 0~2 s 内该反应的平均速率为________ molL-1s-1。在第 5s 时,NO2 的转化率为___________。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________。
③为加快反应速率,可以采取的措施是_______
a.升高温度 b.恒容时充入He气 c.恒压时充入He气 d.恒容时充入NO2