题目内容
水中加入下列溶液对水的电离平衡不产生影响的是( )
| A.NaHSO4溶液 | B.KF溶液 | C.KAl(SO4)2溶液 | D.NaI溶液 |
D
解析

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
一定温度下,卤化银AgX(X:Cl—、Br—、I—)及Ag2CrO4的沉淀溶解平衡曲线如图所示。横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“ -lgc(X-)”或“-lgc(CrO42—)”。下列说法正确的是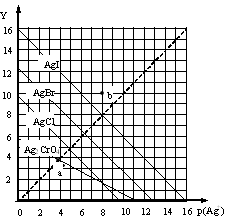
| A.a点表示c(Ag+)=c(CrO42—) |
| B.b点可表示AgI的饱和溶液 |
| C.该温度下AgI的Ksp约为1×10—16 |
| D.该温度下AgCl、AgBr饱和溶液中:c(Cl—)<c(Br—) |
常温下,Ksp(CaSO4)=9´10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是( )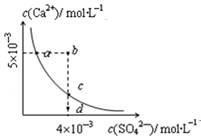
| A.在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
| B.d点溶液通过蒸发可以变到c点 |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于4´10-3 mol·L-1 |
稀氨水中存在下述平衡: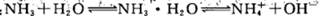 改变下列条件,能使电离程度增大的是
改变下列条件,能使电离程度增大的是
| A.加浓氨水 | B.升高温度 | C.加NH4Cl溶液 | D.加NaOH溶液 |
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是( )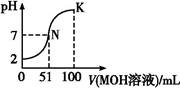
| A.HA可能为一元弱酸 |
| B.MOH为一元强碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(M+)="0.01" mol·L-1 |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中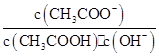 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
下列关于电解质溶液的叙述正确的是 ( )。
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
下列有关说法正确的是( )
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图8-2(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )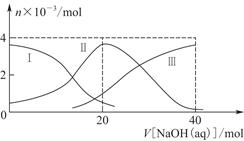
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A=HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |