题目内容
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下1L 0.1 mol﹒L-1的Fe2(SO4)3溶液中含有0.2NA个Fe3+ | |
| B. | 相同质量的Na2O2和Na2S固体具有相同的阴阳离子数和质子数 | |
| C. | 用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L (不考虑氯气的溶解;电池工作时MnO2转化为MnOOH) | |
| D. | 常温下CH3COONH4的pH=7,则0.5 mol﹒L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol•L-1 |
分析 A、铁离子是弱碱阳离子,在溶液中会水解;
B、Na2O2和Na2S的摩尔质量相同,且均含2个阳离子和1个阴离子;
C、求出二氧化锰的物质的量,然后根据二氧化锰反应后由+4价变为+3价来分析转移的电子数目,然后根据电解饱和食盐水时,阳极上是氯离子放电生成氯气来分析;
D、CH3COONH4是弱酸弱碱盐,能发生双水解.
解答 解:A、铁离子是弱碱阳离子,在溶液中会水解,由于Fe3+水解,故其数目小于0.2NA个,故A错误;
B、Na2O2和Na2S摩尔质量相同,故相同质量的两者的物质的量相同,而两者均含2个阳离子和1个阴离子,故物质的量相同时具有相同的阴阳离子数和质子数,故B正确;
C、8.7gMnO2的物质的量为0.1mol,转化为MnOOH时由+4价变为+3价,即转移0.1mol电子,则电解池中阳极上失去0.1mol电子,由于阳极上是氯离子放电生成氯气,当失去0.1mol电子时,阳极上有0.1mol氯离子失电子生成0.05mol氯气,在标况下体积为1.12L,故C错误;
D、CH3COONH4是弱酸弱碱盐,能发生双水解,由于NH4+水解,物质的量浓度小于0.5 mol﹒L-1,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
15. 某学习小组拟研究化学平衡建立以及浓度对化学平衡移动的影响.
某学习小组拟研究化学平衡建立以及浓度对化学平衡移动的影响.
(1)向20mL 0.01mol/L的FeCl3溶液中滴入20滴0.03mol/L的KSCN溶液,相关化学方程式为FeCl3+3KSCN?Fe(SCN)3+3KCl;可观察到的实验现象是浅黄色溶液变成红色.
(2)下列能说明(1)中反应达到平衡的是AC(填序号).
A.溶液颜色不再发生变化 B.反应不再发生
C.Fe3+浓度不再变化 D.K+浓度不再发生变化
E.反应物和产物浓度相等
(3)将上述(1)所得溶液平均分成四份进行下列实验,试完成表格方案.
(4)上述实验中研究反应物浓度减小对平衡移动影响的是②③(填编号);实验③加5mL水的目的是对比实验,消除加入的氢氧化钠溶液导致的溶液稀释对各离子浓度的影响;在实验①中,若tl时刻代表加入试剂的时间,请完成c(Fe3+)~t图象:
(5)根据上述研究,小组提出用比色法测量FeCl3溶液的浓度.
I.比色板的制作
步骤一:(不必回答具体操作);
步骤二:分别取2mL上述FeCl3系列溶液于不同试管中,分别加入5滴0.03mol/L的KSCN溶液,振荡摇匀,在试管上标注相应反应物的浓度并将试管按照颜色由浅到深的顺序排列(比色板).
II.溶液浓度的测定
取5 mL待测FeCl3溶液于试管中,加入5滴0.03mol/L的KSCN溶液.将所得溶液与步骤二的比色板对比,读取待测FeCl3溶液浓度.
 某学习小组拟研究化学平衡建立以及浓度对化学平衡移动的影响.
某学习小组拟研究化学平衡建立以及浓度对化学平衡移动的影响.(1)向20mL 0.01mol/L的FeCl3溶液中滴入20滴0.03mol/L的KSCN溶液,相关化学方程式为FeCl3+3KSCN?Fe(SCN)3+3KCl;可观察到的实验现象是浅黄色溶液变成红色.
(2)下列能说明(1)中反应达到平衡的是AC(填序号).
A.溶液颜色不再发生变化 B.反应不再发生
C.Fe3+浓度不再变化 D.K+浓度不再发生变化
E.反应物和产物浓度相等
(3)将上述(1)所得溶液平均分成四份进行下列实验,试完成表格方案.
| 实验编号 | ① | ② | ③ | |
| 加入试剂 | 5mL 6mol/L FeCl3溶液和5滴0.03mol/L 的KSCN溶液 | 少量铁粉 | 5mL水 | 5mL NaOH溶液 |
| 现象预期 | 红色加深 | 溶液红色变浅 | 加入5mL NaOH溶液后,溶液颜色较加5mL水后更浅(填“更深”“更浅”或“相同”) | |
(5)根据上述研究,小组提出用比色法测量FeCl3溶液的浓度.
I.比色板的制作
步骤一:(不必回答具体操作);
步骤二:分别取2mL上述FeCl3系列溶液于不同试管中,分别加入5滴0.03mol/L的KSCN溶液,振荡摇匀,在试管上标注相应反应物的浓度并将试管按照颜色由浅到深的顺序排列(比色板).
II.溶液浓度的测定
取5 mL待测FeCl3溶液于试管中,加入5滴0.03mol/L的KSCN溶液.将所得溶液与步骤二的比色板对比,读取待测FeCl3溶液浓度.
12.三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖.纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是( )
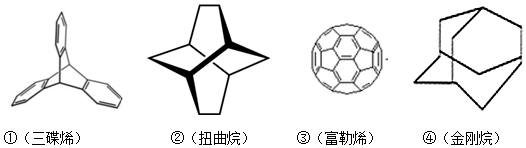

| A. | ①③均能发生加成反应 | B. | ①④互为同分异构体 | ||
| C. | ①②③④均属于烃 | D. | ①②③④的一氯代物均只有一种 |
19.下列离子方程式书写正确的是( )
| A. | 向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | Fe(OH)3沉淀被氢碘酸溶解:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Ca(HCO3)2溶液中加入少量NaOH:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 用铜电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
9.化学与生活、坏境、能源等密切相关,下列说法铕误的是( )
| A. | 太阳能热水器,太阳能电池、由玉米制乙醉部涉及生物质能的利用 | |
| B. | “地沟油”禁止食用,但经加工处理后可用来制造肥皂和生物柴油 | |
| C. | 以淀粉浓液作指示剂,用已知浓度的碘溶液来测定食品中SO2的残留量 | |
| D. | 雾霾属于分散系,减少生产生活中产生的扬尘可以减少雾霾天气的形成 |
16.化学在工农业生产和日常生活中都有着重要的应用.下列说法错误的是( )
| A. | 纯碱可用于制造玻璃,也可用于除去物品表面的油污 | |
| B. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能源 |
3.设NA为阿伏伽德罗常数的数值,则下列说法正确的是( )
| A. | 等质量的CO、N2含有的分子数均为NA | |
| B. | 0.5 mol/L的MgCl2溶液中Cl-离子的物质的量为NA | |
| C. | 常温常压时,4.48 L CH4气体中含有的原子数大于NA | |
| D. | 12克13C含有的碳原子数小于NA |
