题目内容
(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算PM2.5待测试样的pH = 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
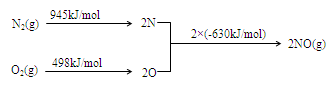
① N2(g)+O2(g)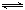 2NO(g)△H= 。
2NO(g)△H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
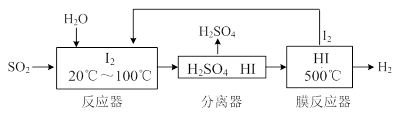
① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO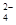 | NO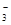 | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

① N2(g)+O2(g)
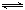 2NO(g)△H= 。
2NO(g)△H= 。②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M
 NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。⑴ 4 ⑵① +183kJ/mol;② 2NO+2CO催化剂 2CO2+N2;③ 不能
⑶① SO2+I2+2H2O=SO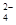 +2I-+4H+
+2I-+4H+
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行
③MH+OH--e-=H2O+M
⑶① SO2+I2+2H2O=SO
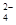 +2I-+4H+
+2I-+4H+ ②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行
③MH+OH--e-=H2O+M
试题分析:(1)题目所示的微粒中阳离子所带的正电荷数是:4×10-6×1+6×10-6×1+2×10-5×1=3×10-5mol/L,阴离子所带的负电荷总数是:2×4×10-5+1×3×10-5+1×2×10-5=13×10-5 mol/L>3×10-5mol/L,根据溶液呈电中性原理,溶液中还应该含有大量的H+。所以溶液显酸性。c(H+)=13×10-5 mol/L-3×10-5mol/L=1×10-4 mol/L,所以pH="4." (2)①反应热就是断裂化学键吸收的热量与形成化学键释放的热量的差值。因此 N2(g)+O2(g
 2NO(g)△H=+945KJ/mol+498KJ/mol-2×630KJ/mol=+183KJ/mol。②NO被CO还原的化学方程式为2NO+2CO催化剂 2CO2+N2;③由于该反应是体系混乱程度减小的吸热反应,体系的自由能大于0,所以设想是不能实现的。① 根据图示可知:用离子方程式表示反应器中发生的反应是:SO2+I2+2H2O=SO
2NO(g)△H=+945KJ/mol+498KJ/mol-2×630KJ/mol=+183KJ/mol。②NO被CO还原的化学方程式为2NO+2CO催化剂 2CO2+N2;③由于该反应是体系混乱程度减小的吸热反应,体系的自由能大于0,所以设想是不能实现的。① 根据图示可知:用离子方程式表示反应器中发生的反应是:SO2+I2+2H2O=SO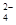 +2I-+4H+。②2HI(g)
+2I-+4H+。②2HI(g) H2(g)+I2(g). HI分解反应是可能反应。在反应中使用膜反应器分离出H2,减小生成物的浓度,平衡正向移动,有利于反应正向进行。③根据总反应方程式可知:在电池放电时,负极电极反应式为MH+OH--e-=H2O+M。2.5的溶液的酸碱性、热化学方程式与化学键的关系、浓度对平衡移动的影响、离子方程式的书写、镍氢电池的电极反应式的书写的知识。
H2(g)+I2(g). HI分解反应是可能反应。在反应中使用膜反应器分离出H2,减小生成物的浓度,平衡正向移动,有利于反应正向进行。③根据总反应方程式可知:在电池放电时,负极电极反应式为MH+OH--e-=H2O+M。2.5的溶液的酸碱性、热化学方程式与化学键的关系、浓度对平衡移动的影响、离子方程式的书写、镍氢电池的电极反应式的书写的知识。
练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
 K(g)+NaCl(l)
K(g)+NaCl(l)  (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2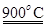 mCeO2+xH2+xCO
mCeO2+xH2+xCO HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
 2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是 2SO3(g)在一个体积不变的密闭容器中反应,达到平衡状态的标志是( )
2SO3(g)在一个体积不变的密闭容器中反应,达到平衡状态的标志是( )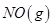 和足量
和足量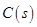 ,发生反应
,发生反应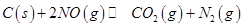 ,平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是
,平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是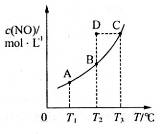
 时的平衡常数分别为
时的平衡常数分别为 ,则
,则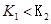
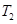 时,若反应体系处于状态D,则这时一定有
时,若反应体系处于状态D,则这时一定有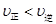
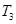 时,若混合气体的密度不再变化,则可以判断反应达到平衡状态
时,若混合气体的密度不再变化,则可以判断反应达到平衡状态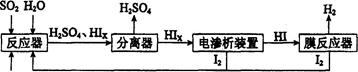
 H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
 =4时,CO2的转化率随时间的变化关系如图1所示.
=4时,CO2的转化率随时间的变化关系如图1所示.
 4NO(g)+6H2O(g)ΔH=-a kJ·mol-1
4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 4NO2(g)+O2(g) ΔH=+d kJ·mol-1
4NO2(g)+O2(g) ΔH=+d kJ·mol-1