题目内容
(2007?天津)天津是我国研发和生产锂离子电池的重要基地.锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6
CoO2+LiC6,下列说法正确的是( )
| 充电 |
| 放电 |
分析:由电解池的总反应来确定充放电时的电极反应,由于单质锂较活泼,易与羧酸以及醇反应而变质,电解质不能含有羧酸和醇.
解答:解:A、充电时,电池的负极和阴极相连,发生得电子的还原反应,故A错误;
B、放电时,电池的正极发生得电子的还原反应,CoO2+Li++e-=LiCoO2,故B正确;
C、由于单质锂较活泼,易与醇以及羧酸类物质反应而变质,电解质不能含有醇和羧酸,故C错误.
D、锂离子电池的比能量高,故D错误.
故选B.
B、放电时,电池的正极发生得电子的还原反应,CoO2+Li++e-=LiCoO2,故B正确;
C、由于单质锂较活泼,易与醇以及羧酸类物质反应而变质,电解质不能含有醇和羧酸,故C错误.
D、锂离子电池的比能量高,故D错误.
故选B.
点评:本题考查锂电池的组成好工作原理,题目难度不大,本题注意锂电池的组成和工作原理,注意从总电池反应根据化合价的变化判断.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
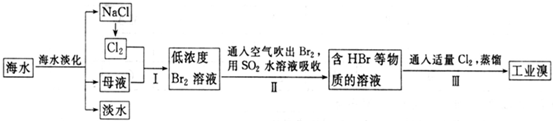
(08山东高考冲刺卷)(8分)2007年10月是索尔维制碱法命名140周年纪念,1867年在巴黎世界博览会上,将氨碱法正式命名为索尔维制碱法。该法广泛为世界各国采用,后被中国的侯氏制碱法所取代。索尔维法的生产流程是:
 |
索尔维法能实现连续生产,但食盐利用率只有70,且副产品CaCl2没有用途,污染环境。
1940年我国化学家侯德榜先生经过多次实验,冲破了“索尔维法”的技术封锁,并加以改进,食盐利用率达96,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”。其基本原理是:
①在30℃~50℃的饱和食盐水中,先通入氨饱和,再通入CO2得碳酸氢钠沉淀。
②过滤,将滤渣加热而得副产品。
③在滤液中加入细食盐末,在10℃~15℃,使NH4Cl沉淀,过滤,滤液为饱和食盐水。
请完成下列问题:
(1)在氨的饱和NaCl溶液中通入CO2的两步反应方程式:
______ ___________。
(2)不能在NaCl溶液中通入CO2制NaHCO3的原因是____________________。
(3)析出小苏打的母液中加入生石灰的反应方程式:_______________。
(4)在“侯氏制碱法”中,_______物质可以循环利用,在“索尔维法”中___________物质可以循环利用。
(5)“侯氏制碱法”与“索尔维”相比,其优点是___________。