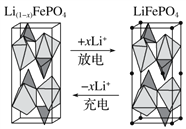
题目内容
【题目】(1)3.01×1024个OH﹣的物质的量为____,质量为___,这些OH﹣与标准状况下__L NH3的物质的量相等,如果这些OH﹣来自2L的Ba(OH)2溶液,则该Ba(OH)2的物质的量浓度为__.
(2)同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的质量之比为___,所含电子数之比为__,相同质量的氨气和硫化氢气体的分子数之比为______密度之比为______.
(3)标况下8.96L 的CH4和CO混合气体,其质量为7.60g,则平均摩尔质量为____________,CH4和CO物质的量之比为________________。
(4)已知100mLAl2(SO4)3溶液中Al3+ 浓度为0.6mol/L,则SO42-的浓度为______________,Al2(SO4)3的物质的量为_____________(不考虑Al3+ 水解)
【答案】 5mol 85g 112 1.25mol/L 1:2 5:9 2:1 1:2 19g/mol 3:1 0.9mol/L 0.03mol
【解析】试题分析:(1)根据![]() 计算OH﹣的物质的量和质量;根据
计算OH﹣的物质的量和质量;根据![]() 计算NH3的体积;根据
计算NH3的体积;根据![]() 计算Ba(OH)2的物质的量浓度;(2)根据阿伏加德罗定律,同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等;根据阿伏加德罗定律的推论分析相同质量的氨气和硫化氢气体的分子数之比、密度之比;(3)标况下8.96L 的CH4和CO混合气体的总物质的量
计算Ba(OH)2的物质的量浓度;(2)根据阿伏加德罗定律,同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等;根据阿伏加德罗定律的推论分析相同质量的氨气和硫化氢气体的分子数之比、密度之比;(3)标况下8.96L 的CH4和CO混合气体的总物质的量![]() ,其质量为7.60g,根据
,其质量为7.60g,根据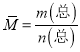 计算平均摩尔质量;(4)根据Al2(SO4)3=2Al3++3SO42-计算SO42-的浓度;根据n=cv计算Al2(SO4)3的物质的量。
计算平均摩尔质量;(4)根据Al2(SO4)3=2Al3++3SO42-计算SO42-的浓度;根据n=cv计算Al2(SO4)3的物质的量。
解析:(1)根据![]() ,3.01×1024个OH﹣的物质的量
,3.01×1024个OH﹣的物质的量![]() 5mol,质量m=5mol×17g/mol=85g,5mol NH3在标准状况下的体积是5mol×22.4L/mol=112L。如果5molOH﹣来自Ba(OH)2,则Ba(OH)2的物质的量是2.5mol,根据
5mol,质量m=5mol×17g/mol=85g,5mol NH3在标准状况下的体积是5mol×22.4L/mol=112L。如果5molOH﹣来自Ba(OH)2,则Ba(OH)2的物质的量是2.5mol,根据![]() ,该Ba(OH)2的物质的量浓度为
,该Ba(OH)2的物质的量浓度为![]() =1.25mol/L。
=1.25mol/L。
(2)根据阿伏加德罗定律,同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等,设NH3、H2S 的物质的量都是1mol,则NH3、H2S的质量分别是17g、34g,所以质量之比为17:34=1:2,1个NH3分子含10个电子,1个H2S防止含18个电子,所含电子数之比为10:18=5:9;根据阿伏伽德罗定律的推论,相同质量的气体,分子数比等于摩尔质量的反比,所以相同质量的氨气和硫化氢气体分子数之比为34:17=2:1;同温同压,气体的密度比等于摩尔质量的比,密度之比为17:34=1:2。
(3)标况下8.96L 的CH4和CO混合气体的物质的量是![]() ,其质量为7.60g,根据
,其质量为7.60g,根据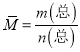 ,平均摩尔质量为
,平均摩尔质量为![]() 19g/mol,设CH4和CO物质的量分别是xmol、ymol,则
19g/mol,设CH4和CO物质的量分别是xmol、ymol,则![]() ,解得
,解得![]() ,CH4和CO物质的量之比为3:1。
,CH4和CO物质的量之比为3:1。
(4)100mLAl2(SO4)3溶液中Al3+ 浓度为0.6mol/L,Al3+的物质的量是0.1L×0.6mo/L=0.06mol, 根据Al2(SO4)3=2 Al3++3SO42-,则SO42-的浓度为0.9mol/L,Al2(SO4)3的物质的量为0.03mol。

 名校课堂系列答案
名校课堂系列答案