题目内容
0.1mol/L KHSO4和0.1mol/L Na2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系不正确的是( )
| A、c(SO42-)>c(HS-)>c(OH-)>c(H+) |
| B、c(Na+)=c(S2-)+c(H2S)+c(HS-)+c(SO42-) |
| C、c(Na+)+c(K+)+c(H+)=2c(SO42-)+2c(S2-)+c(HS-)+c(OH-) |
| D、c(Na+)>c(K+)>c(H+)>c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:0.1mol/L KHSO4和0.1mol/L Na2S溶液等体积混合后,生成HS-,溶液能使pH试纸变蓝,则溶液呈碱性,说明HS-水解程度大于HS-电离程度,结合溶液中的电荷守恒、物料守恒解答该题.
解答:
解:A.混合后生成HS-,HS-水解,则[SO42-]>[HS-],溶液呈碱性,[OH-]>[H+],所以[SO42-]>[HS-]>[OH-]>[H+],故A正确;
B.0.1mol/L KHSO4和0.1mol/L Na2S溶液等体积混合,由元素质量守恒可知:n(Na)=n(S),则有:[Na+]=[S2-]+[H2S]+[HS-]+[SO42-],故B正确;
C.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(K+)+c(H+)=2c(SO42-)+2c(S2-)+c(HS-)+c(OH-),故C正确;
D.溶液能使pH试纸变蓝,溶液呈碱性,[OH-]>[H+],故D错误;
故选D.
B.0.1mol/L KHSO4和0.1mol/L Na2S溶液等体积混合,由元素质量守恒可知:n(Na)=n(S),则有:[Na+]=[S2-]+[H2S]+[HS-]+[SO42-],故B正确;
C.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(K+)+c(H+)=2c(SO42-)+2c(S2-)+c(HS-)+c(OH-),故C正确;
D.溶液能使pH试纸变蓝,溶液呈碱性,[OH-]>[H+],故D错误;
故选D.
点评:本题考查了离子浓度大小比较,根据反应物的量确定混合溶液中的溶质及溶液酸碱性,再结合守恒思想分析解答,题目难度中等.

练习册系列答案
相关题目
a是一种难溶于水的氧化物,能熔于熔融态的烧碱,生成易溶于水的化合物b,将少量b溶液滴入盐酸中,最终能生成一种白色的胶状沉淀,则a为( )
| A、CO2 |
| B、SiO2 |
| C、Al2O3 |
| D、MgO |
下列化学用语的理解正确的是( )
| A、29Cu的价电子排布式为3d94s2 |
| B、HClO的结构式:H-Cl-O |
C、比例模型  ,可以同时表示CH4和CCl4分子 ,可以同时表示CH4和CCl4分子 |
| D、1s22s22p3 和 1s22s22p4能形成AB2型共价化合物 |
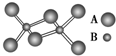 某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8电子稳定结构.下列关于该化合物的说法不正确的是( )
某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8电子稳定结构.下列关于该化合物的说法不正确的是( )| A、化学式是Al2Cl6 |
| B、不存在离子键和非极性共价键 |
| C、在固态时所形成的晶体是分子晶体 |
| D、是离子化合物,在熔融状态下能导电 |
1mol MnO2与含4mol HCl的浓盐酸共热,在不考虑HCl挥发的情况下得到氯气为( )
| A、2mol |
| B、1mol |
| C、小于1mol |
| D、大于2mol |
最新报道,绿色农药--信息素已推广使用.这对环境保护有重要意义.有一种信息素的结构简式为CH3(CH2)5CH=CH(CH2)9CHO 下列关于检验该信息素的官能团的试剂和顺序正确的是( )
| A、先用新制氢氧化铜悬浊液检验醛基,再用溴水检验碳碳双键 |
| B、先用酸性高锰酸钾溶液检验碳碳双键,再用银氨溶液检验醛基 |
| C、先用溴水检验碳碳双键,再用新制氢氧化铜悬浊液检验醛基 |
| D、先用银氨溶液检验醛基,再用氢气/催化剂检验碳碳双键 |
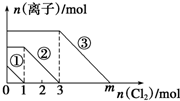 向仅含Fe2+、I-、Br-的溶液中(忽略由水电离出的H+和OH-)通入一定量的氯气,溶液中这三种离子物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+、I-、Br-的溶液中(忽略由水电离出的H+和OH-)通入一定量的氯气,溶液中这三种离子物质的量的变化如图所示.下列说法中正确的是( )| A、③代表I-的变化情况 |
| B、①代表Fe2+的变化情况 |
| C、m的数值等于9 |
| D、原混合溶液中n(FeBr2)=3 mol |
化学实验室,金属钠着火时,可选择的灭火材料是( )
| A、干冰(CO2固体)灭火器 |
| B、沙子 |
| C、泡沫灭火器 |
| D、水 |