题目内容
14.用铂电极电解某金属的氯化物(MCl2)溶液,当阳极上收集到1.12LCl2时(标准状况),阴极增重3.2g.下列有关叙述正确的是( )| A. | M的相对原子质量为32 | B. | M的相对原子质量为64 | ||
| C. | 电解过程中溶液的pH不发生变化 | D. | 电路中通过0.05mol电子 |
分析 用铂电极电解某金属的氯化物(MCl2)溶液,当阳极上收集到1.12LCl2时(标准状况),n(Cl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,阴极增重3.2g,
A.生成0.05mol氯气转移0.1mol电子,根据转移电子相等计算M的相对原子质量;
B.生成0.05mol氯气转移0.1mol电子,根据转移电子相等计算M的相对原子质量;
C.根据题干知,电解过程中放电物质是电解质,该氯化物是强酸弱碱盐,水溶液呈酸性;
D.根据氯气和转移电子之间的关系式计算.
解答 解:用铂电极电解某金属的氯化物(MCl2)溶液,当阳极上收集到1.12LCl2时(标准状况),n(Cl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,阴极增重3.2g,
A.生成0.05mol氯气转移物质的量=0.05mol×2=0.1mol,根据转移电子相等知,生成M的物质的量=$\frac{0.1mol}{2}$=0.05mol,根据转移电子相等得M摩尔质量=$\frac{3.2g}{0.05mol}$=64g/mol,摩尔质量在数值上等于其相对原子质量,所以M的相对原子质量是64,故A错误;
B.根据A知,M的相对原子质量是64,故B正确;
C.根据题干知,电解过程中放电物质是电解质,该氯化物是强酸弱碱盐,水溶液呈酸性,所以随着电解的进行,溶液的pH增大,故C错误;
D.根据氯气和转移电子之间的关系式得转移电子物质的量=0.05mol×2=0.1mol,故D错误;
故选B.
点评 本题考查电解原理,侧重考查分析计算能力,明确溶质的性质利用转移电子守恒解答即可,易错选项是C,题目难度不大.

练习册系列答案
相关题目
2.一定条件下,发生如下反应:2A(g)+2B(g)?3C(g)+D(g)在容积不变的密闭容器中进行,达到化学平衡状态的标志是( )
| A. | 单位时间内生成n mol B,同时消耗3n mol C | |
| B. | 容器内压强不随时间而变化 | |
| C. | 混合气体的密度不随时间变化 | |
| D. | 单位时间内生成2n mol A,同时生成n mol D |
9.下列反应符合如图图示的是( )
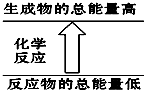

| A. | 铝片与盐酸的反应 | B. | 消石灰与NH4Cl晶体的反应 | ||
| C. | 酸碱中和反应 | D. | 甲烷在氧气中的燃烧反应 |
19.当CH3COOH?CH3COO-+H+已达平衡,若要使醋酸的电离平衡向左移动和溶液的pH值都减小,应加入的试剂是( )
| A. | CH3COONa | B. | NH3•H2O | C. | HCl | D. | H2O |
6.用石墨作电极,电解CuSO4溶液,一段时间后,阴极上只析出铜,要恢复到原浓度,应向溶液中加入( )
| A. | Cu(OH) 2 | B. | Cu | C. | CuSO4 | D. | CuO |
4.下列分散系不能发生丁达尔现象的是( )
| A. | 豆浆 | B. | 牛奶 | C. | 食盐溶液 | D. | 烟、云、雾 |
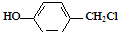 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 ;
; ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 ;
;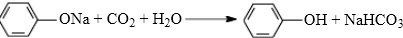 .
.