题目内容
(10分)向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)―→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段: 。
第二阶段: 。
(2)正确表达这两个阶段反应中,加入铁粉的物质的量与溶液中铁元素存在的形式的关系
。
(3)在图中画出溶液中Fe2+、Fe3+、NO的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。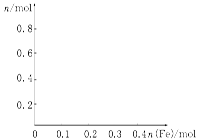
第一阶段为:Fe+HNO3(稀)―→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段: 。
第二阶段: 。
(2)正确表达这两个阶段反应中,加入铁粉的物质的量与溶液中铁元素存在的形式的关系
。
(3)在图中画出溶液中Fe2+、Fe3+、NO的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。

(1)Fe+4H++NO=Fe3++NO↑+2H2O 2Fe3++Fe=3Fe2+
(2)①加入Fe粉为0~0.2 mol时,存在形式为Fe3+;
②加入铁粉为0.2~0.3 mol时,存在形式为Fe2+和Fe3+;
③加Fe粉为n(Fe)≥0.3 mol时,存在形式为Fe2+。
(3)如图: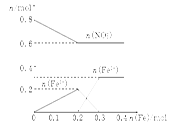
(2)①加入Fe粉为0~0.2 mol时,存在形式为Fe3+;
②加入铁粉为0.2~0.3 mol时,存在形式为Fe2+和Fe3+;
③加Fe粉为n(Fe)≥0.3 mol时,存在形式为Fe2+。
(3)如图:

试题分析:(1)第一阶段的离子方程式为:Fe+4H++NO=Fe3++NO↑+2H2O。第二阶段加入的Fe会将生成的Fe3+还原成Fe2+,离子方程式为2Fe3++Fe=3Fe2+。
(2)第一阶段中0.8mol硝酸消耗铁粉0.2mol,产生Fe3+0.2mol,第二阶段消耗铁粉0.1mol,产生Fe2+0.3mol,所以当铁粉加入量大于0.2mol小于0.3mol时,既有Fe3+,又有Fe2+。
(3)此过程的图像为
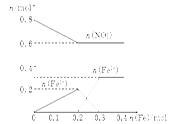
点评:本题难度较大,主要考查学生分析各个阶段Fe的存在方式。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目