题目内容
3.对于反应4NH3+5O2═4NO+6H2O,下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )| A. | v (NH3)=0.25 mol/(L•s) | B. | v (O2)=1.4mol/(L•min) | ||
| C. | v (H2O)=0.25 mol/(L•s) | D. | v (NO)=9 mol/(L•min) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位要一致,以此来解答.
解答 解:不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,
A.$\frac{0.25}{4}$=0.0625;
B.$\frac{\frac{1.4}{60}}{5}$=0.0047;
C.$\frac{0.25}{6}$=0.042;
D.$\frac{\frac{9}{60}}{4}$=0.0375,
显然A中比值最大,反应速率最快,
故选A.
点评 本题考查化学反应速率快慢的比较,为高频考点,把握速率与化学计量数的关系为解答的关键,注意转化法、比值法均可比较反应速率大小,注意单位保持一致,题目难度不大.

练习册系列答案
相关题目
13.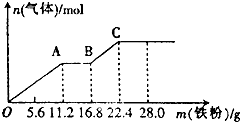 某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原混合溶液中NO3-的物质的量为0.4 mol | |
| B. | OA段、BC段产生的气体分别是N0、H2 | |
| C. | 第二份溶液中最终溶质为FeS04 | |
| D. | 原混合溶液中H2S04的浓度为5 mol•L-1 |
14.下列实验现象预测或实验操作或实验原理正确的是( )


| A. | 实验Ⅰ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性:Cl2>Br2>I2 | |
| B. | 实验Ⅱ:当溶液至红褐色,停止加热,让光束通过体系时可产生丁达尔现象 | |
| C. | 实验Ⅲ:可通过铜丝的上下移动来控制NO2的制取并收集NO2气体 | |
| D. | 实验Ⅳ:振荡后静置,溶液不再分层,且保持无色透明 |
11.化学与人类生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | “天宫一号”中使用的碳纤维,是一种纤维素 | |
| B. | 回收制革工厂的边角皮料生产食用明胶,加工成医用胶囊或做食品增稠剂 | |
| C. | 氯化汞(HgCl2)的稀溶液可用于手术器械消毒,因为它会使蛋白质变性,杀菌消毒 | |
| D. | 蛋白质、淀粉、纤维素、油脂、葡萄糖等都能在人体内水解并提供能量 |
18.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
8.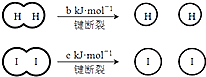 H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-akJ•mol-1已知:(a、b、c均大于零),下列说法不正确的是( )
H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-akJ•mol-1已知:(a、b、c均大于零),下列说法不正确的是( )
 H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-akJ•mol-1已知:(a、b、c均大于零),下列说法不正确的是( )
H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-akJ•mol-1已知:(a、b、c均大于零),下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ |
12.设计燃料电池使汽油氧化直接产生电流,是重要的课题之一.最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气(以辛烷为汽油的代表物),电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.下列说法正确的是( )
| A. | 固体电解质里O2-的移动方向是由负极到正极 | |
| B. | 电池工作时电流由通汽油蒸汽的电极经外电路到通空气的电极 | |
| C. | 负极的电极反应式为C8H18+25O2--50e-═8CO2+9H2O | |
| D. | 正极的电极反应式为O2+2H2O+4e-═4OH- |
13.鉴别下列各组物质的水溶液所选的试剂(括号内)中不正确的是( )
| A. | 淀粉、鸡蛋清(碘水) | B. | 葡萄糖、福尔马林[新制Cu(OH)2悬浊液] | ||
| C. | 食盐、纯碱(盐酸) | D. | 白酒、食醋(NaCl溶液) |
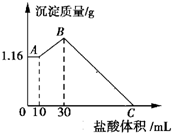 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,有1.16g 白色沉淀生成,再向所得的悬浊液中逐滴加入1mol•L-1 盐酸,加入盐酸的体积V与生成沉淀的质量关系如图所示.试回答下列问题:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,有1.16g 白色沉淀生成,再向所得的悬浊液中逐滴加入1mol•L-1 盐酸,加入盐酸的体积V与生成沉淀的质量关系如图所示.试回答下列问题: