题目内容
难挥发性二硫化担(TaS2)可采用如下装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
下列说法正确的是
| A.该反应的△H>0 |
| B.在提纯过程中,S2的量不断增加 |
| C.该反应的平衡常数与I2的浓度成正比 |
| D.经过足够长时间后,石英管右端将得到纯净的TaS2 |
C
解析试题分析:依题意,高温区不纯的TaS2(s)与I2(g)发生反应生成TaI4(g)和S2(g),低温区TaI4(g)和S2(g)发生反应生成TaS2(s)与I2(g),而杂质则留在高温区,说明升高温度平衡向正反应方向移动,由于升高温度平衡向吸热方向移动,则正反应是吸热反应,正反应的△H>0,故A正确;高温区生成S2(g)的物质的量等于低温区消耗S2(g)的物质的量,所以S2(g)的量不会改变,只能高温区生成的S2(g)比消耗的S2(g)多,低温区消耗的S2(g)比生成的S2(g)多,故B错误;固体物质不能写入平衡常数表达式,则该反应的平衡常数等于平衡时TaI4(g)和S2(g)的物质的量浓度幂之积与I2(g)的物质的量浓度的2次方的比值,即平衡常数与平衡时I2(g)的物质的量浓度成反比例,故C错误;经过足够长的时间,石英管右端将得到熔沸点较高的杂质,左端将得到纯净的、熔沸点较低的TaS2(s),故D错误。
考点:考查温度对平衡移动的影响,涉及焓变正负的推断、混合物分离提纯的反应原理、平衡常数表达式、纯净产物与杂质的位置等。

 综合自测系列答案
综合自测系列答案某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。 向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐 加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )
| A.原混合酸中NO3-物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为 Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
下列说法正确的是
| A.除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 |
| B.某温度时,纯水中c(H+)=2×10-7mol·L-1,则c(OH-)=5×10-8mol·L-1 |
C.N2(g)+3H2(g) 2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小 2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小 |
D.Na2CO3溶液中存在平衡:CO32-+H2O HCO3-+OH一,升高温度溶液碱性增强 HCO3-+OH一,升高温度溶液碱性增强 |
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。在下列因素中对产生H2速率有影响的是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
| A.①④ | B.③④ | C.①②③ | D.②③ |
对于可逆反应M + 3N  2Q 达到平衡时,下列说法正确的是( )
2Q 达到平衡时,下列说法正确的是( )
| A.M、N、Q三种物质的浓度一定相等 | B.M、N全部变成了Q |
| C.反应混合物各组分的浓度不再变化 | D.反应已经停止 |
在一固定容积的密闭容器中进行如下反应:2SO (g)+O
(g)+O (g)
(g) 2SO
2SO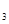 (g),已知反应进行到10秒时,SO
(g),已知反应进行到10秒时,SO 、O
、O 、SO
、SO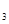 的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
A.10秒时,用O 表示该反应的平均反应速率为0.01 mol/(L·s) 表示该反应的平均反应速率为0.01 mol/(L·s) |
B.当反应达平衡时,SO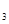 的物质的量可能为0.4 mol 的物质的量可能为0.4 mol |
C.当SO 和O 和O 的生成速率之比为2:1时,达到该反应限度 的生成速率之比为2:1时,达到该反应限度 |
D.向容器内充人SO ,可以提高反应速率 ,可以提高反应速率 |
下列说法不正确的是
| A.原电池负极被氧化 |
| B.任何化学反应都能设计成原电池 |
| C.化学反应的速率和限度均可通过改变化学反应条件而改变 |
| D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
 2C(g),根据下表中的数据判断下列图像错误的是
2C(g),根据下表中的数据判断下列图像错误的是

 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是