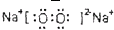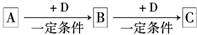题目内容
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下图所示的转化关系:
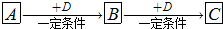
(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色气体,A、C中含有相同元素,该元素在元素周期表中的位置为 .
(2)若A元素属于短周期主族金属元素,B为白色固体,C为淡黄色固体,D是具有氧化性的单质,则A与D直接反应生成C的条件为 .
(3)若A、B、C、D分别为C、CO、CO2、O2,已知A、B的燃烧热分别为△HA=-393.5 kJ?mol-1、△HB=-283.0 kJ?mol-1,则A与D反应生成B的热化学方程式为 .
(4)若A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,D是能使品红溶液褪色的气体,A电离出的阴离子的电子式为 ;C转化为B的离子方程式为 .
(5)若D为氯碱工业的主要产品,B具有两性,则A、C两溶液混合的现象为 ;D溶液逐滴滴入A中直至过量,反应过程中的现象为 .
(6)若B是相对分子质量为64的氧化物,含氧50%,B气体通入H2S的溶液中出现淡黄色浑浊现象,其中发生反应的化学方程式为 ,当用NaOH吸收B,且吸收液呈中性时,溶液中离子浓度c(Na+)= .
(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色气体,A、C中含有相同元素,该元素在元素周期表中的位置为
(2)若A元素属于短周期主族金属元素,B为白色固体,C为淡黄色固体,D是具有氧化性的单质,则A与D直接反应生成C的条件为
(3)若A、B、C、D分别为C、CO、CO2、O2,已知A、B的燃烧热分别为△HA=-393.5 kJ?mol-1、△HB=-283.0 kJ?mol-1,则A与D反应生成B的热化学方程式为
(4)若A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,D是能使品红溶液褪色的气体,A电离出的阴离子的电子式为
(5)若D为氯碱工业的主要产品,B具有两性,则A、C两溶液混合的现象为
(6)若B是相对分子质量为64的氧化物,含氧50%,B气体通入H2S的溶液中出现淡黄色浑浊现象,其中发生反应的化学方程式为
分析:(1)若A能使湿润的红色石蕊试纸变蓝,则A是NH3,C为红棕色气体,则C是NO2,A、C中含有相同元素,氨气和氧气反应生成一氧化氮,一氧化氮被氧气氧化生成二氧化氮,所以D是O2,B是NO;
(2)若A元素属于短周期主族金属元素,B为白色固体,C为淡黄色固体,D是具有氧化性的单质,则C是Na2O2,A是Na,D是O2,B是Na2O;
(3)若A、B、C、D分别为C、CO、CO2、O2,已知A、B的燃烧热分别为△HA=-393.5kJ/mol、△HB=-283.0kJ/mol,根据盖斯定律书写;
(4)若A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,则A是NaOH,D是能使品红溶液褪色的气体,则D是SO2,B是Na2SO3,C是NaHSO3,
(5)若D为氯碱工业的主要产品,B具有两性,B和D能反应,则D是NaOH,B是Al(OH)3,A为可溶性铝盐,C是NaAlO2;
(6)若B是相对分子质量为64的氧化物,含氧50%,B气体通入H2S的溶液中出现淡黄色浑浊现象,则B是SO2,二氧化硫和硫化氢反应生成硫和水,当用NaOH吸收B,且吸收液呈中性时,根据电荷守恒判断.
(2)若A元素属于短周期主族金属元素,B为白色固体,C为淡黄色固体,D是具有氧化性的单质,则C是Na2O2,A是Na,D是O2,B是Na2O;
(3)若A、B、C、D分别为C、CO、CO2、O2,已知A、B的燃烧热分别为△HA=-393.5kJ/mol、△HB=-283.0kJ/mol,根据盖斯定律书写;
(4)若A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,则A是NaOH,D是能使品红溶液褪色的气体,则D是SO2,B是Na2SO3,C是NaHSO3,
(5)若D为氯碱工业的主要产品,B具有两性,B和D能反应,则D是NaOH,B是Al(OH)3,A为可溶性铝盐,C是NaAlO2;
(6)若B是相对分子质量为64的氧化物,含氧50%,B气体通入H2S的溶液中出现淡黄色浑浊现象,则B是SO2,二氧化硫和硫化氢反应生成硫和水,当用NaOH吸收B,且吸收液呈中性时,根据电荷守恒判断.
解答:解:(1)若A能使湿润的红色石蕊试纸变蓝,则A是NH3,C为红棕色气体,则C是NO2,A、C中含有相同元素,氨气和氧气反应生成一氧化氮,一氧化氮被氧气氧化生成二氧化氮,所以D是O2,B是NO,A和C中相同元素是N元素,N原子核外有2个电子层,最外层有5个电子,所以N元素位于第二周期第VA族,
故答案为:第二周期第VA族;
(2)若A元素属于短周期主族金属元素,B为白色固体,C为淡黄色固体,D是具有氧化性的单质,则C是Na2O2,A是Na,D是O2,B是Na2O,钠在空气中加热生成过氧化钠,所以其条件是加热,故答案为:加热;
(3)若A、B、C、D分别为C、CO、CO2、O2,已知A、B的燃烧热分别为△HA=-393.5kJ/mol、△HB=-283.0kJ/mol,
①C(s)+O2(g)=CO2(g)△HA=-393.5kJ/mol
②CO(g)+
O2(g)=CO2(g)△HB=-283.0kJ/mol
根据盖斯定律得①-②得C(s)+
O2(g)=CO(g)△H=-110.5KJ/mol,
故答案为:C(s)+
O2(g)=CO(g)△H=-110.5KJ/mol;
(4)若A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,则A是NaOH,D是能使品红溶液褪色的气体,则D是SO2,B是Na2SO3,C是NaHSO3,A电离出的阴离子是氢氧根离子,其电子式为: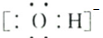 ,亚硫酸氢钠和氢氧化钠反应生成亚硫酸钠,离子反应方程式为:HSO3-+OH-=SO32-+H2O,故答案为:
,亚硫酸氢钠和氢氧化钠反应生成亚硫酸钠,离子反应方程式为:HSO3-+OH-=SO32-+H2O,故答案为: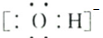 ;HSO3-+OH-=SO32-+H2O;
;HSO3-+OH-=SO32-+H2O;
(5)若D为氯碱工业的主要产品,B具有两性,B和D能反应,则D是NaOH,B是Al(OH)3,A为可溶性铝盐,C是NaAlO2,可溶性铝盐和偏铝酸钠反应生成难溶性的氢氧化铝,所以看到的现象是有白色沉淀生成,氯化铝和氢氧化钠反应先生成白色沉淀,当氢氧化钠过量时,氢氧化钠再和氢氧化铝反应生成可溶性的偏铝酸钠,所以看到的现象是:先生成白色沉淀,后沉淀逐渐消失,
故答案为:有白色沉淀生成;先有白色沉淀生成,最后白色沉淀消失;
(6)若B是相对分子质量为64的氧化物,含氧50%,B气体通入H2S的溶液中出现淡黄色浑浊现象,则B是SO2,二氧化硫和硫化氢反应生成硫和水,反应方程式为:SO2+2H2S=3S↓+2H2O,
当用NaOH吸收B,且吸收液呈中性时,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32- ),所以得c(Na+)=c(HSO3-)+2c(SO32-),
故答案为:SO2+2H2S=3S↓+2H2O;c(HSO3-)+2c(SO32-).
故答案为:第二周期第VA族;
(2)若A元素属于短周期主族金属元素,B为白色固体,C为淡黄色固体,D是具有氧化性的单质,则C是Na2O2,A是Na,D是O2,B是Na2O,钠在空气中加热生成过氧化钠,所以其条件是加热,故答案为:加热;
(3)若A、B、C、D分别为C、CO、CO2、O2,已知A、B的燃烧热分别为△HA=-393.5kJ/mol、△HB=-283.0kJ/mol,
①C(s)+O2(g)=CO2(g)△HA=-393.5kJ/mol
②CO(g)+
| 1 |
| 2 |
根据盖斯定律得①-②得C(s)+
| 1 |
| 2 |
故答案为:C(s)+
| 1 |
| 2 |
(4)若A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,则A是NaOH,D是能使品红溶液褪色的气体,则D是SO2,B是Na2SO3,C是NaHSO3,A电离出的阴离子是氢氧根离子,其电子式为:
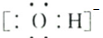 ,亚硫酸氢钠和氢氧化钠反应生成亚硫酸钠,离子反应方程式为:HSO3-+OH-=SO32-+H2O,故答案为:
,亚硫酸氢钠和氢氧化钠反应生成亚硫酸钠,离子反应方程式为:HSO3-+OH-=SO32-+H2O,故答案为: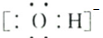 ;HSO3-+OH-=SO32-+H2O;
;HSO3-+OH-=SO32-+H2O;(5)若D为氯碱工业的主要产品,B具有两性,B和D能反应,则D是NaOH,B是Al(OH)3,A为可溶性铝盐,C是NaAlO2,可溶性铝盐和偏铝酸钠反应生成难溶性的氢氧化铝,所以看到的现象是有白色沉淀生成,氯化铝和氢氧化钠反应先生成白色沉淀,当氢氧化钠过量时,氢氧化钠再和氢氧化铝反应生成可溶性的偏铝酸钠,所以看到的现象是:先生成白色沉淀,后沉淀逐渐消失,
故答案为:有白色沉淀生成;先有白色沉淀生成,最后白色沉淀消失;
(6)若B是相对分子质量为64的氧化物,含氧50%,B气体通入H2S的溶液中出现淡黄色浑浊现象,则B是SO2,二氧化硫和硫化氢反应生成硫和水,反应方程式为:SO2+2H2S=3S↓+2H2O,
当用NaOH吸收B,且吸收液呈中性时,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32- ),所以得c(Na+)=c(HSO3-)+2c(SO32-),
故答案为:SO2+2H2S=3S↓+2H2O;c(HSO3-)+2c(SO32-).
点评:本题考查了无机物的推断,涉及离子浓度大小的比较、反应现象的描述、离子方程式的书写等知识点,根据物质的特殊颜色、特殊性质结合物质之间的转化关系来进行推断,明确物质的性质是解本题关键,难度中等.

练习册系列答案
相关题目


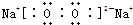
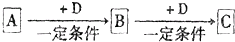 已知A、B、C是中学化学的常见物质,它们在一定条件下有如图所示转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如图所示转化关系: