题目内容
17.某元素原子构成的气态单质分子(双原子分子)有三种,其相对分子质量分别为70、72、74.此三种分子的物质的量之比是9:6:1.则下列叙述中正确的是( )| A. | 质量数为35的同位素的原子质量百分比为75% | |
| B. | 该元素有二种同位素 | |
| C. | 该元素的双原子分子的平均相对分子质量为72 | |
| D. | 该元素的一种同位素的质量数为36 |
分析 A.根据三种单质的物质的量之比为9:6:1进行计算;
B.依据双原子单质分子有三种,确定该元素存在两种同位素;
C.根据三种单质的物质的量之比为9:6:1,结合平均式量=$\frac{总质量}{总物质的量}$进行计算;
D.依据两种同位素形成的三种单质的式量分析两种同位素的质量数为35、37.
解答 解:A.元素构成的双原子单质分子有三种,其式量分别为70、72、74,此三种单质的物质的量之比为9:6:1,故质量数为35的同位素原子的个数比为$\frac{9×2+6}{(9+6+1)×2}$=75%,而不是质量比,故A错误;
B.元素构成的双原子单质分子有三种,其式量分别为70、72、74,推断该元素存在两种同位素,故B正确;
C.该元素的双原子分子的平均相对分子质量=$\frac{总质量}{总物质的量}$=$\frac{70×9+72×6+74×1}{9+6+1}$=71,故C错误;
D.根据双原子单质分子有三种,其式量分别为70、72、74可知,最大的式量为37X2,最小式量为35X2,所以质量数不可能为36,故D错误;
故选B.
点评 本题考查元素同位素的综合应用,依据同位素为载体考查质量数的确定和计算,平均式量的计算方法,难度中等.正确理解同位素的概念和特征应用是解题的关键.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目
7.下列有关结构中,C原子有可能处于同一平面上的最大组合是( )
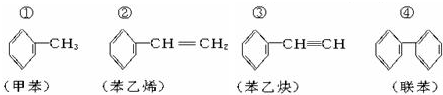

| A. | ①④ | B. | ②③ | C. | ①②④ | D. | 全部 |
8.下列说法正确的是( )
| A. | 物质发生化学反应都伴随着能量变化,但不一定会引起状态的变化 | |
| B. | 伴随着能量变化的物质变化都是化学变化 | |
| C. | 反应物的总能量低于反应产物的总能量,此反应需加热才进行 | |
| D. | 反应物的总能量高于反应产物的总能量,此反应在任何条件下都可进行 |
12.糖类、油脂和蛋白质都是人类必需的基本营养物质,下列关于它们的说法中不正确的( )
| A. | CuSO4溶液能使蛋白质变性 | |
| B. | 糖类、油脂和蛋白质都属于高分子化合物 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 淀粉、油脂和蛋白质都能发生水解反应 |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 46gNO2和N2O4的混气体中,含氮原子数目是NA | |
| B. | 1.0L 0.1mol/L的NaF溶液中,含F-离子数目是0.1NA | |
| C. | 11.2L的H2中,含有的电子数目是NA | |
| D. | 1molFeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目是NA |
9.根据表中左栏信息,回答右栏有关问题:
| 信 息 | 问 题 |
| ①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数.其中X是形成化合物种类最多的元素. | (1)X元素的最高价氧化物的电子式是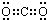 |
| ②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液. | (2)Z元素在元素周期表中位于第 三周期, ⅢA族. |
| ③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成. | (3)写出生成白色沉淀的化学方程式 MgCl2+2NaOH═Mg(OH)2↓+2NaCl. |
| ④向上述四种元素的单质的混合物中加入足量的烧碱,固体部分溶解,过滤,向滤液中加入过量 的盐酸溶液,最终溶液中有白色沉淀. | (4)最终生成白色沉淀的离子方程式为 SiO32-+2H+=H2SO3↓. |
| (5)X、Y、Z、W四种元素的原子半径由大到小的顺序为 Mg>Al>Si>C(用元素符号表示) | |
6.下列物质:①乙烷;②苯;③聚氯乙烯;④2-丁炔;⑤环己烷;⑥邻二甲苯;⑦3-甲基-1-戊烯.其中能使酸性KMnO4溶液褪色,也能与溴水发生化学反应而褪色的是( )
| A. | ③④⑤⑦ | B. | ③④⑦ | C. | ④⑦ | D. | ④⑥⑦ |
7.下列物质是电解质的为( )
| A. | 硫黄 | B. | 硫酸钠 | C. | 酒精 | D. | 硝酸钾溶液 |
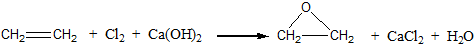
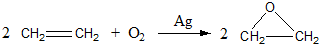
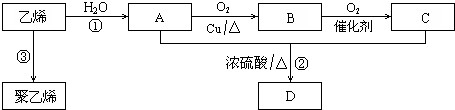
 ;反应类型:加聚反应.
;反应类型:加聚反应.