题目内容
17.已知25℃,101KPa下,0.4molCH4燃烧生成CO2和液态水放出356KJ热量,写出该反应的热化学方程式CH4(g)+2O2(g)→CO2(g)+H2O(l)△H=-890 kJ/mol.分析 依据热化学方程式书写方法,标注物质聚集状态和反应焓变,通过题干条件计算对应物质燃烧反应放出的热量.
解答 解:0.4mol CH4完全燃烧生成CO2和液态H2O时,放出356kJ热量,1mol甲烷燃烧生成二氧化碳和液态水放热890kJ,反应的热化学方程式为:
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890kJ/mol,
故答案为:CH4(g)+2O2(g)→CO2(g)+H2O(l)△H=-890 kJ/mol.
点评 本题考查了热化学方程式的书写方法,注意物质状态的标注和焓变的计算,题目较简单.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
7.下列说法正确的是( )
| A. | 纤维素和淀粉互为同分异构体 | |
| B. | 油脂发生皂化反应可生成脂肪酸和丙醇 | |
| C. | 酯类物质是产生水果香味的主要成分 | |
| D. | 糖类、蛋白质都属于天然高分子化合物 |
8.下列说法正确的是( )
| A. | 乙烯的结构简式可表示为CH2CH2 | |
| B. | 苯、乙醇、乙酸都能发生取代反应 | |
| C. | 甲烷可以与氯气反应,而乙烯不能与氯气反应 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
12.化学与社会、生产、生活紧密相关.下列说法不正确的是( )
| A. | 常用75%的酒精用于伤口消毒 | |
| B. | 可以用米汤来检验碘单质的存在 | |
| C. | 用聚氯乙烯代替聚乙烯做食品包装袋,有利于节约成本,更环保 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
2.I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示.
其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图 .
.
(2)列举一个事实说明W非金属性强于Z:2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(用化学方程式表示)
II.运用所学化学原理,解决下列问题:
(3)已知:Si+2NaOH+H2O═Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O;
(4)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1;
(5)已知:CO(g)+H2O(g) $?_{△}^{催化剂}$ H2(g)+CO2(g).右表为该反应在不同温度时的平衡常数.
则:该反应的△H<0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为75%.
| X | ||||
| Y | Z | W |
(1)写出X的原子结构示意图
 .
.(2)列举一个事实说明W非金属性强于Z:2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(用化学方程式表示)
II.运用所学化学原理,解决下列问题:
(3)已知:Si+2NaOH+H2O═Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O;
(4)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1;
(5)已知:CO(g)+H2O(g) $?_{△}^{催化剂}$ H2(g)+CO2(g).右表为该反应在不同温度时的平衡常数.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
9.糖类、油脂和蛋白质是生命活动所必需的营养物质.下列叙述正确的是( )
| A. | 蛋白质遇浓硫酸变为黄色 | B. | 蔗糖水解产物仅有葡萄糖 | ||
| C. | 纤维素不能水解成葡萄糖 | D. | 油脂水解产物之一是甘油 |
6.如图1和图2是A、B两种物质的核磁共振氢谱.请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式( )
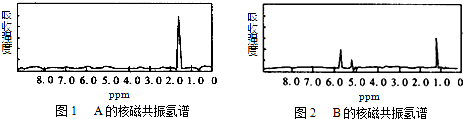

| A. | A是C3H6、B是C2H6 | B. | A是C6H6、B是C4H6 | C. | A是C6H6、B是C2H6 | D. | A是C3H8、B是C6H6 |
4.食品安全、资源充分利用、保护环境备受关注,下列做法与此理念相违背的是( )
| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成生物柴油,提高资源的利用率 | |
| C. | 发展光伏发电等高效清洁能源,缓解能源危机 | |
| D. | 大力发展公共交通,提高汽油的质量,对减轻雾霾很有必要 |
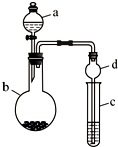 某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题:
某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题: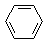 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$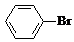 +HBr.向c中滴加AgNO3溶液,可观察到的现象是产生浅黄色沉淀.
+HBr.向c中滴加AgNO3溶液,可观察到的现象是产生浅黄色沉淀.