题目内容
0.5molCH4约含有________个CH4,其质量为________g,标准状况下的体积________L;3.01×1023个SO42-约含________molSO42-,其质量为________g;等质量的CO和SO2的物质的量之比为________,碳原子和硫原子的物质的量之比________,氧原子的物质的量之比________.
0.5NA 8 11.2 0.5 48 16:7 16:7 8:7
分析:根据N=nNA计算0.5molCH4含有的CH4分子数目,根据m=nM计算0.5molCH4的质量,利用V=nVm计算0.5molCH4的体积;
根据n=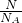 计算SO42-的物质的量,根据m=nM计算SO42-的质量;
计算SO42-的物质的量,根据m=nM计算SO42-的质量;
令CO和SO2的为1g,根据n= 计算CO和SO2的物质的量,根据分子式可知n(C)=n(CO)、n(S)=n(SO2),CO中n(O)=n(CO)、SO2中n(O)=2n(SO2),据此计算.
计算CO和SO2的物质的量,根据分子式可知n(C)=n(CO)、n(S)=n(SO2),CO中n(O)=n(CO)、SO2中n(O)=2n(SO2),据此计算.
解答:0.5molCH4约含有CH4分子数为0.5mol×NAmol-1=0.5NA,其质量为0.5mol×16g/mol=8g,在标准状况下的体积为0.5mol×22.4L/mol=11.2L;
3.01×1023个SO42-的物质的量为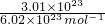 =0.5mol,其质量为0.5mol×96g/mol=48g;
=0.5mol,其质量为0.5mol×96g/mol=48g;
令CO和SO2的为1g,则n(CO)=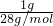 =
=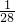 mol,n(SO2)=
mol,n(SO2)=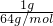 =
=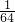 mol,所以CO和SO2的物质的量之比为
mol,所以CO和SO2的物质的量之比为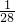 mol:
mol: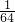 mol=16:7,含有的碳原子和硫原子的物质的量之比为为
mol=16:7,含有的碳原子和硫原子的物质的量之比为为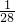 mol:
mol: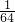 mol=16:7,含有氧原子的物质的量之比
mol=16:7,含有氧原子的物质的量之比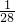 mol:
mol: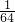 mol×2=8:7.
mol×2=8:7.
故答案为:0.5NA;8;11.2L;0.5;48;16:7;16:7;8:7.
点评:本题考查常用化学计量的有关计算,比较基础,注意公式的掌握与灵活运用.
分析:根据N=nNA计算0.5molCH4含有的CH4分子数目,根据m=nM计算0.5molCH4的质量,利用V=nVm计算0.5molCH4的体积;
根据n=
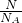 计算SO42-的物质的量,根据m=nM计算SO42-的质量;
计算SO42-的物质的量,根据m=nM计算SO42-的质量;令CO和SO2的为1g,根据n=
 计算CO和SO2的物质的量,根据分子式可知n(C)=n(CO)、n(S)=n(SO2),CO中n(O)=n(CO)、SO2中n(O)=2n(SO2),据此计算.
计算CO和SO2的物质的量,根据分子式可知n(C)=n(CO)、n(S)=n(SO2),CO中n(O)=n(CO)、SO2中n(O)=2n(SO2),据此计算.解答:0.5molCH4约含有CH4分子数为0.5mol×NAmol-1=0.5NA,其质量为0.5mol×16g/mol=8g,在标准状况下的体积为0.5mol×22.4L/mol=11.2L;
3.01×1023个SO42-的物质的量为
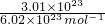 =0.5mol,其质量为0.5mol×96g/mol=48g;
=0.5mol,其质量为0.5mol×96g/mol=48g;令CO和SO2的为1g,则n(CO)=
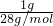 =
=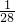 mol,n(SO2)=
mol,n(SO2)=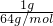 =
=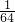 mol,所以CO和SO2的物质的量之比为
mol,所以CO和SO2的物质的量之比为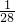 mol:
mol: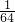 mol=16:7,含有的碳原子和硫原子的物质的量之比为为
mol=16:7,含有的碳原子和硫原子的物质的量之比为为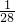 mol:
mol: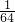 mol=16:7,含有氧原子的物质的量之比
mol=16:7,含有氧原子的物质的量之比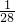 mol:
mol: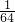 mol×2=8:7.
mol×2=8:7.故答案为:0.5NA;8;11.2L;0.5;48;16:7;16:7;8:7.
点评:本题考查常用化学计量的有关计算,比较基础,注意公式的掌握与灵活运用.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目