��Ŀ����
����Ŀ���״���һ����Ҫ�Ļ���ԭ�Ϻ�����ȼ�ϡ�
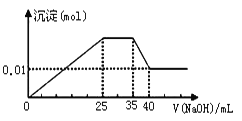
(1)��ҵ��һ����CO��H2Ϊԭ�����ܱ������кϳɼ״���CO(g)��2H2(g)![]() CH3OH(g)����H����90.8 kJ��mol��1�����ݻ�Ϊ1 L�ĺ��������У��ֱ��о���230 ����250 ����270 �������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶���H2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ��������Z��Ӧ���¶���________�����¶���������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ________��
CH3OH(g)����H����90.8 kJ��mol��1�����ݻ�Ϊ1 L�ĺ��������У��ֱ��о���230 ����250 ����270 �������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶���H2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ��������Z��Ӧ���¶���________�����¶���������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ________��
(2)��ͼ�Ǽ״�ȼ�ϵ�ع�����ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��

I.���и����ĵ缫��ӦʽΪ_________ _______
II�����з�Ӧ�Ļ�ѧ����ʽΪ______ __ ________��A�������������ڱ�״���µ����Ϊ________________��
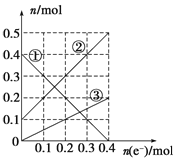
III����װ����Һ�н��������ӵ����ʵ�����ת�Ƶ��ӵ����ʵ����仯��ϵ����ͼ����ͼ�Т��߱�ʾ����________�ı仯����Ӧ������Ҫʹ��װ���н���������ǡ����ȫ��������Ҫ________ mL 5.0 mol��L��1 NaOH��Һ��
���𰸡�
��1��270 �棻4��
��2����.CH3OH��6e����8OH��===CO��6H2O
��. 2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��2H2O
2Cu+O2��+2H2SO4��2H2O![]() O2��+2H2����2.24 L��
O2��+2H2����2.24 L��
III��Fe2����280
��������
�����������1�����ݸ÷�ӦΪ���ȷ�Ӧ���¶�Խ��CO��ת����ԽС����������ZΪ270����
��ͼ���֪��270��ʱ��CO��ת����Ϊ50%��n��H2����n��CO��=1.5����
CO��g��+2H2��g��CH3OH(g)
��ʼ��mol/L�� 1 1.5 0
ת����mol/L�� 0.5 1 0.5
ƽ�⣨mol/L�� 0.5 0.5 0.5
K=![]() =
=![]() =4��
=4��
�ʴ�Ϊ��270����4��
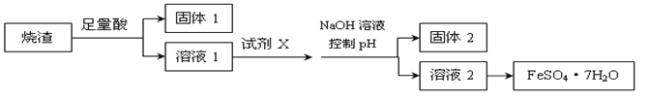
��2�������״�ȼ�ϵ����ԭ��ط�Ӧ���״��ڸ���ʧ���ӷ���������Ӧ���缫��ӦΪ��
CH3OH-6e-+8OH-=CO32-+6H2O��
�ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
���������ڵ��װ�ã�AΪ������BΪ��������ʼʱ��ⷴӦ�Ļ�ѧ����ʽΪ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��һ��ʱ���ͭ����ȫ���μӷ�Ӧ��ⷽ��ʽΪ��2H2O
2Cu+O2��+2H2SO4��һ��ʱ���ͭ����ȫ���μӷ�Ӧ��ⷽ��ʽΪ��2H2O![]() O2��+2H2��������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ�������缫��Ӧ��BΪ��������Һ��ͭ���������������ӵõ����������������������������ʵ���ΪX����Һ��ͭ�������ʵ���Ϊ0.1mol���缫��ӦΪ��
O2��+2H2��������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ�������缫��Ӧ��BΪ��������Һ��ͭ���������������ӵõ����������������������������ʵ���ΪX����Һ��ͭ�������ʵ���Ϊ0.1mol���缫��ӦΪ��
Cu2++ 2e-=Cu��
0.1mol 0.2mol
2H++2e-=H2����
2x x
A�缫Ϊ��������Һ�е�����������ʧ���������������缫��ӦΪ��
4OH--4e-=2H2O+O2����
4x x
���ݵ�ʧ�����غ�õ�0.2+2x=4x��
x=0.1mol
����A�����������������������ʵ���Ϊ0.1mol���ڱ�״���µ����Ϊ2.24L��
�ʴ�Ϊ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��2H2O
2Cu+O2��+2H2SO4��2H2O![]() O2��+2H2����2.24L��
O2��+2H2����2.24L��
��������ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯����֪��ͭ���Ӵ������࣬���������ʵ�����С�������������ӣ�����ΪFe3+����ΪFe2+����ΪCu2+����ͼ��֪����ת��Ϊ0.4mol������Cu2+���ʵ���Ϊ0.2mol�������缫��ӦFe3++e-=Fe2+����Ӧ��������Һ����Fe2+Ϊ0.5mol��Cu2+Ϊ0.2mol��������Ҫ����NaOH��Һ0.5��2+0.2��2=1.4mol����������NaOH��Һ�����Ϊ1.4/5=0.28L=280mL��
�ʴ�Ϊ��Fe2+��280

 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�