题目内容
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
试回答下列问题。
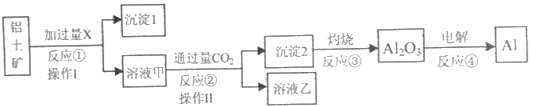
(1)试剂X为___;反应①的离子方程式为___。
(2)操作Ⅰ、操作Ⅱ均为___(填操作名称)。反应①②③④中属于氧化还原反应的是___(填数字序号)。
(3)反应②的离子方程式为___。
(4)金属铝与氧化铁的混合物在高温下会发生剧烈的反应,该反应的化学方程式为___。(5)电解熔融氧化铝制取金属铝,若有0.6mol电子发生转移,理论上能得到金属铝的质量是___g。
【答案】氢氧化钠溶液 Al2O3+2OH-=2AlO2-+H2O 过滤 ④ CO2+AlO2—+2H2O =Al(OH)3↓+HCO3— 2Al+Fe2O3![]() 2Fe+Al2O3 5.4
2Fe+Al2O3 5.4
【解析】
由电解Al2O3得到Al倒推知:滤液甲中含有铝元素,通入CO2生成氢氧化铝沉淀。说明加入试剂X为氢氧化钠,则生成滤液甲中含有偏铝酸钠,滤液乙NaHCO3
(1)滤液甲中含有铝元素,通入CO2生成氢氧化铝沉淀,说明甲中含有偏铝酸钠,加入试剂X为氢氧化钠溶液;反应①的离子方程式为:Al2O3+2OH-=2AlO2-+H2O
(2)操作Ⅰ、操作Ⅱ均为将固体与液体分离,操作为过滤;反应①②③均无价态变化,不属于氧化还原反应,④电解熔融氧化铝制取金属铝有化合价改变,属于氧化还原反应。
(3)CO2过量生成HCO3—不是CO32—,CO2+ AlO2— + 2H2O = Al(OH)3↓+ HCO3—
(4)金属铝与氧化铁的混合物在高温下会发生铝热反应:2Al+Fe2O3![]() 2Fe+Al2O3。
2Fe+Al2O3。
(5)分析电解熔融氧化铝制取金属铝电子转移的关系:![]()
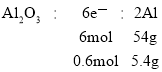
所以理论得到铝的质量为5.4g。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目