题目内容
【题目】下列说法正确的是( )
A. 凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体
B. H—O键键能为463 kJ/mol,即18gH2O分解成H2和O2时,消耗能量为2×463 kJ
C. sp3杂化轨道是由同一原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
【答案】C
【解析】凡是中心原子采取![]() 杂化轨道成键的分子不一定都是正四面体,比如
杂化轨道成键的分子不一定都是正四面体,比如![]() ,就属于三角锥形,A错误;H—O键键能为463 kJ/mol,说明断裂2mol氢氧键消耗能量为926千焦,但生成氢气、氧气分子时会放出能量,所以18克水分解成氢气和氧气时,消耗能量小于926千焦;B错误;
,就属于三角锥形,A错误;H—O键键能为463 kJ/mol,说明断裂2mol氢氧键消耗能量为926千焦,但生成氢气、氧气分子时会放出能量,所以18克水分解成氢气和氧气时,消耗能量小于926千焦;B错误;![]() 杂化轨道的定义就是“由同一原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道,C正确;比如
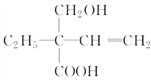
杂化轨道的定义就是“由同一原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道,C正确;比如![]() 就属于
就属于![]() 杂化,D错误;正确选项C。
杂化,D错误;正确选项C。

练习册系列答案
相关题目
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2