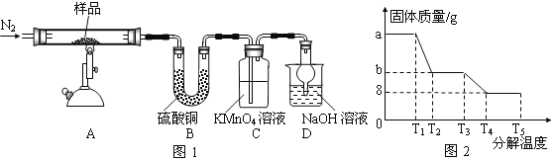
题目内容
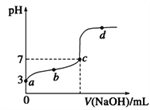
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。

试回答下列问题:
(1)写出反应过程中DE段的离子反应方程式:__________,EF段生成含氧元素离子的名称是_______________。
(2)合金中,铝的质量为_________g,铁的质量为_____________g 。
(3)C的值为______________mL。
(4)硝酸溶液的物质的量浓度为____________mol·L-1。
【答案】 NH4++OH-=NH3H2O 偏铝酸根或四羟基合铝酸根 0.216 1.344 7 1.48
【解析】本题主要考查硝酸的性质。
(1)反应过程中DE段沉淀的物质的量不变,反应的离子方程式:NH4++OH-=NH3H2O,EF段氢氧化铝转化为偏铝酸钠或四羟基合铝酸钠,生成含氧元素离子的名称是偏铝酸根或四羟基合铝酸根。
(2)溶解氢氧化铝消耗2mL氢氧化钠溶液,对应地氢氧化铝的物质的量为4 mol L -1 ×2mL=0.008mol,所以合金中,铝的质量为0.008mol×27g/mol=0.216g,反应NH4++OH-=NH3H2O消耗3mL氢氧化钠溶液,NH4+的物质的量为4 mol L -1 ×3mL=0.012mol,NH4+为还原产物,Fe3+、Al3+为氧化产物,根据电子守恒可得8n(NH4+)=3n(Al3+)+3n(Fe3+),n(Fe3+)=0.24mol,所以铁的质量为0.024mol×56g/mol=1.344g。
(3)E点溶液为硝酸钠溶液,此时硝酸钠的物质的量为4 mol L -1 ×34mL=0.136mol,在C对应的溶液中含有硝酸钠、硝酸铁、硝酸铝、硝酸铵,硝酸根的物质的量为n(NH4+)+3n(Al3+)+3n(Fe3+)+4mol/LC=0.136mol,C=7。
(4)E点溶液中硝酸钠的物质的量为0.136mol,NH3H2O的物质的量为0.012mol,所以硝酸的物质的量为0.136mol+0.012mol=0.148mol,硝酸溶液的物质的量浓度为0.148mol/100mL=1.48mol·L-1。