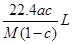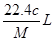题目内容
标准状况下H2和Cl2组成的混合气体2.24L,经点燃充分反应后,缓缓通入100mL 1.2mol/LNaOH溶液中恰好完全反应,测得最终溶液中NaClO的浓度为0.2mol/L(假设溶液体积不变),则原混合气体中Cl2的体积分数(物质的量百分含量)为
| A.55% | B.60% | C.65% | D.70% |
B
解析试题分析:标准状况下2.24LH2和Cl2组成的混合气体的物质的量为2.24/22.4=0.1mol,最终有NaClO生成,说明氢气与氯气反应氯气有剩余,由于氢气与氯气按1:1反应,故混合气体中氯气的物质的量大于0.05mol,NaOH的物质的量为0.1L×1mol/L=0.1mol,由于HCl与NaOH反应生成NaCl,Cl2与NaOH反应生成NaCl、NaClO,由钠原子与氯原子关系可知,NaOH不足,反应生成NaClO的物质的量为0.1L×0.1mol/L=0.01mol,根据方程式Cl2+2NaOH=NaClO+NaCl+H2O可知,与剩余氯气反应的NaOH的物质的量为0.01mol×2=0.02mol,故与HCl反应的NaOH的物质的量为0.1mol-0.02mol=0.08mol,由HCl+NaOH=NaCl+H2O可知,HCl的物质的量为0.08mol,根据氢元素守恒可知氢气的物质的量为0.08/2=0.04mol故混合物中氯气的物质的量为0.1mol-0.04mol=0.06mol,氯气的体积分数为0.06/0.1=×100%=60%,
考点:本题考查混合物的有关计算,难度较大,根据氯原子与钠原子关系,判断混合气体反应后剩余的氯气与氢氧化钠反应氢氧化钠的量不足是解题关键,为易错题,容易认为剩余的氯气被氢氧化钠完全吸收,

HCl极易溶于水,标准状况下将一充满HCl的烧瓶倒置在水槽中,溶液充满整个烧瓶,此时烧瓶中溶液的物质的量浓度为:( )
| A.无法计算 | B.0.015mol/L | C.0.011 mol/L | D.0.045 mol/L |
一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是
| A.该温度和压强可能是标准状况 |
| B.该气体中每个分子含有2个原子 |
| C.若O2在该条件下为气态,则1 mol O2在该条件下的体积也为30 L |
| D.标准状况下该纯净物若为气态,其体积约是22.4 L |
硫酸铜水溶液呈酸性,属保护性无机杀菌剂,对人畜比较安全,其与石灰乳混合可得“波尔多液”。实验室里需用180mL0.10mol·L-1的硫酸铜溶液,则应选用的容量瓶规格和称取溶质的质量分别为
| A.180mL容量瓶,称取2.88g硫酸铜 |
| B.200mL容量瓶,称取5.00g胆矾 |
| C.250mL容量瓶,称取6.25g胆矾 |
| D.250mL容量瓶,称取4.0g硫酸铜 |
下列溶液与20mL 1 mol·L–1 NaNO3溶液中NO3–物质的量浓度相等的是( )
| A.10 mL 0.5 mol·L–1 Cu(NO3)2溶液 | B.5 mL 0.8 mol·L–1 Al(NO3)3溶液 |
| C.10 mL 2 mol·L–1 AgNO3溶液 | D.10 mL 1 mol·L–1 Mg(NO3)2溶液 |
用已准确称量过的氯化钠固体配制2.00mol·L-1的NaCl溶液0.2L,需要用到的仪器是:
①坩埚②分液漏斗③容量瓶④烧杯⑤胶头滴管⑥烧瓶⑦玻璃棒⑧托盘天平⑨药匙
| A.③④⑤⑦⑨ | B.①②⑤⑥⑧ | C.③④⑤⑦ | D.③④⑤⑥ |
下列有关化学用语表示正确的是( )
| A.3—甲基—1—丁烯的结构简式:(CH3)2CHCH=CH2 |
B.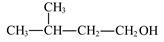 的名称是3-甲基丁醇 的名称是3-甲基丁醇 |
C.乙炔的分子结构模型示意图: |
D.CH4Si的结构式: |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是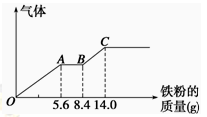
| A.原混合酸中NO3-物质的量为0.1 mol |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
 )溶于ag水中,所得溶液的密度为
)溶于ag水中,所得溶液的密度为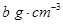 ,物质的量浓度为
,物质的量浓度为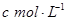 ,则该气体溶入水中的体积是
,则该气体溶入水中的体积是