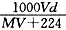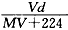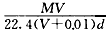题目内容
一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是
| A.该温度和压强可能是标准状况 |
| B.该气体中每个分子含有2个原子 |
| C.若O2在该条件下为气态,则1 mol O2在该条件下的体积也为30 L |
| D.标准状况下该纯净物若为气态,其体积约是22.4 L |
A
解析试题分析:一定温度和压强下,30L某种气态纯净物中含有6.02×1023个分子物质的量为1mol,这些分子由1.204×1024个原子组成即2mol原子构成;A、标准状况下该纯净物若为气态,物质的量为1mol,其体积约是22.4 L,而不是30L,故A不正确;B、依据计算1mol分子中含有2mol原子,该气体中每个分子含有2个原子,故B正确;C、同温、同压、同物质的量的气体体积相同,所以若O2在该条件下为气态,则1 mol O2在该条件下的体积也为30 L,故C正确;D、题干1mol气体的体积为30L,所以该温度和压强不可能是标准状况,在标准状况1mol气体体积约为22.4L,故D正确,答案选A。
考点:考查物质的量以及气体摩尔体积的有关计算和判断

设NA为阿伏加德罗常数的值,则下列说法正确的是( )
A.常温下,0.1 mol碳酸钠晶体中含有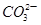 的数目小于0.1 NA 的数目小于0.1 NA |
| B.36gCaO2中含有的离子数目为0.15 NA |
| C.100 g 98%的浓硫酸中,氧原子总数为4NA |
| D.标准状况下,14.2 g氯气与足量石灰乳充分反应转移电子数为0.2NA |
下列化学用语正确的是( )
A.CO2的电子式: |
B.次氯酸的电子式: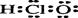 |
C.CH4分子的比例模型: |
D.Cl-的结构示意图: |
下列溶液中的氯离子数目与50 mL 1 mol·L-1的AlCl3溶液中氯离子数目相等的是
| A.150 mL 1 mol·L-1的KClO3 | B.150 mL 3 mol·L-1的KCl |
| C.75 mL 2 mol·L-1的CaCl2 | D.75 mL 2 mol·L-1的NH4Cl |
由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比不可能为
| A.39:24:13 | B.22:7:14 | C.13:8:29 | D.26:16: 57 |
20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是
| A.20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0 mol·L-1 |
| B.20℃时,将29.8 gKCl溶于87.6 g水中可得饱和溶液 |
| C.20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 |
| D.将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变 |
标准状况下H2和Cl2组成的混合气体2.24L,经点燃充分反应后,缓缓通入100mL 1.2mol/LNaOH溶液中恰好完全反应,测得最终溶液中NaClO的浓度为0.2mol/L(假设溶液体积不变),则原混合气体中Cl2的体积分数(物质的量百分含量)为
| A.55% | B.60% | C.65% | D.70% |
下列有关“规定”正确的是
| A.PH小于7的雨水称为酸雨 |
| B.空气中直径大于2.5μm的颗粒物称为PM2.5 |
| C.分散质粒子直径介于1nm~100nm之间的分散系称为胶体 |
| D.标况下的气体摩尔体积为22.4L |