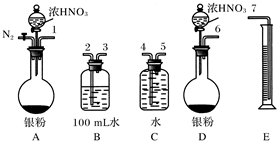
题目内容
| |||||||||||
答案:
解析:
解析:
(1) |
解:a2O2+2CO2=2Na2CO3+O2Δm 2156 0.08mol0.04mol2.24g V(CO2)=22.4L/mol×0.08mol=1.792L 2NO+O2=2NO22NO2=N2O4Δn 0.10.040.08211 0.020.01 转化率=0.02/0.08×100%=25% ①1.792L、25%; ②当活塞由C移向B时,气体体积扩大,使平衡 2NO2=N2O4向左移动,以至NO2与N2O4 的混合气体物质的量增多 |
(2) |
解:O+O2=2NO2 2NO2=N2O4 2NO+O2=N2O4Δn 11 0.010.01 2Na2O2+2CO2=2Na2CO3+O2 21 0.020.01 m(Na2O2)=0.02mol×78g/mol=1.56g 1.56g |

练习册系列答案
相关题目


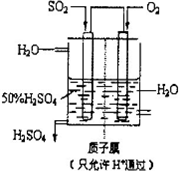 (2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.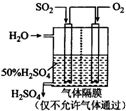 硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+
硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+