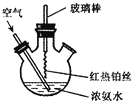
题目内容
【题目】根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各离子浓度的关系正确的是:
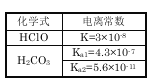
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3-)>c(H+)
C.c(ClO-)+c(HClO)=c(HCO3-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
【答案】A
【解析】
试题分析:A、由表中信息可知,电离常数:H2CO3>HClO>HCO3->H2O,由酸越弱其对应盐的水解程度越大可知,水解程度(或转化率):HCO3-<ClO-(一般都在10%以下),则达到水解平衡时盐溶液中:c(HCO3-)>c(ClO-)>c(OH-),A正确;B、由表中数据可知,H2CO3的酸性大于HClO,则ClO-的水解程度大于HCO3-,则c(HCO3- )>c(ClO-),B错误;C、物质的量浓度相等NaClO、NaHCO3混合溶液中,根据物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),C错误;D.由电荷守恒可知,溶液中存在c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),D错误,答案选A。

【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)